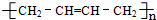题目内容
4.反应①和②分别是从海藻灰和某种矿石中提取碘的主要反应①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2.
下列说法正确的是( )
| A. | 两个反应中均为硫元素被氧化 | |
| B. | 反应①、②中生成等量的I2时转移电子数比为1:5 | |
| C. | 氧化性:MnO2>SO42->IO3->I2 | |
| D. | 碘元素在反应①中被还原,在反应②中被氧化 |
分析 A.失电子化合价升高的元素被氧化;
B.根据碘和转移电子之间的关系式计算;
C.自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
D.失电子化合价升高的元素被氧化,得电子化合价降低的元素被还原.
解答 解:A.在反应①中硫元素既不被氧化也不被还原,在反应②中被氧化,故A错误;
B.反应①中生成1mol碘转移2NA电子,反应②中生成1mol碘转移10NA电子,所以反应①、②中生成等量的I2时转移电子数比为2NA:10NA=1:5,故B正确;
C.氧化性I03->SO42-,故C错误;
D.碘元素在反应①中被氧化,在反应②中被还原,故D错误;
故选B.
点评 本题考查氧化还原反应,明确反应中元素的化合价变化是解答本题的关键,注意利用化合价计算转移的电子数,题目难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
14.如图所示为一种天然产物,具有一定的除草功效,下列有关该化合物的说法错误的是( )
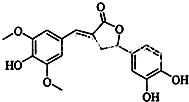

| A. | 分子中含有三种含氧官能团 | |
| B. | 1 mol 该化合物最多能与5mol NaOH反应 | |
| C. | 既可以发生取代反应,又能够发生加成反应 | |
| D. | 能与FeCl3发生显色反应,不能和NaHCO3反应放出CO2 |
15.已知5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O,下列说法不正确的是( )
| A. | KClO3是氧化剂 | |
| B. | 被氧化与被还原的氯元素的质量比为5:1 | |
| C. | Cl2既是氧化产物又是还原产物 | |
| D. | 0.1mol KClO3 参加反应时有1mol电子转移 |
12.某研究性学习小组利用下列有关装置对SO2的性质及空气中SO2的含量进行探究(装置的气密性已检查):
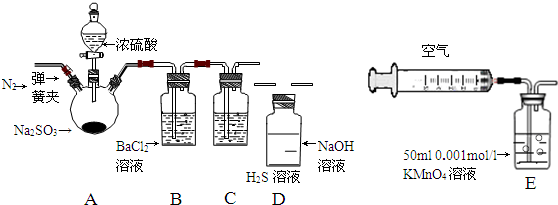
(1)装置A中反应的化学方程式是Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O.
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹.此操作的目的是排除装置中氧气对实验的干扰.
(3)实验过程装置B中没有明显变化.实验结束取下装置B,从中分别取少量溶液于两支洁净试管中.向第1支试管中滴加适量氨水出现白色沉淀BaSO3(填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-.
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有氧化性.
(5)装置D的作用是吸收SO2尾气,防止污染空气.
(6)实验后,测定装置D中溶液呈碱性.溶液为什么呈碱性呢?大家有两种不同的假设:①是生成的Na2SO3水解;②是氢氧化钠剩余.请设计实验方案证明哪种假设成立.可任选下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
(7)另一小组利用装置E进行实验:SO2性质实验之后,用注射器对实验室内空气进行取样.并向装置E中共注入V mL(已折算为标况下体积)的空气,当溶液刚好褪色时,停止实验.请计算该空气中SO2的体积分数(用含V的代数式表示)$\frac{2.8}{V}$.

(1)装置A中反应的化学方程式是Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O.
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹.此操作的目的是排除装置中氧气对实验的干扰.
(3)实验过程装置B中没有明显变化.实验结束取下装置B,从中分别取少量溶液于两支洁净试管中.向第1支试管中滴加适量氨水出现白色沉淀BaSO3(填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-.
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有氧化性.
(5)装置D的作用是吸收SO2尾气,防止污染空气.
(6)实验后,测定装置D中溶液呈碱性.溶液为什么呈碱性呢?大家有两种不同的假设:①是生成的Na2SO3水解;②是氢氧化钠剩余.请设计实验方案证明哪种假设成立.可任选下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
| 实验步骤 | 实验操作 | 预期现象与结论 |
| 1 | 取少量溶液于试管,滴入几滴酚酞 | 溶液变红 |
| 2 | 然后加入足量的BaCl2溶液 | 溶液中产生白色沉淀,最后若红色褪去,则说明①正确;若红色不能褪去,则说明②正确 |
19.下表为元素周期表前4周期的一部分,且X、Y、Z、R和W为主族元素.下列说法正确的是( )
| X | ||
| Y | Z | R |
| W |
| A. | 五种元素的原子最外层电子数一定大于2 | |
| B. | 五种元素一定都是非金属元素 | |
| C. | Z的氧化物与X单质在任何条件下都不会发生置换反应 | |
| D. | R的最外层电子数一定为5 |
9.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为4NA | |
| C. | 1 mol甲基的电子数目为10NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
13.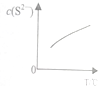 硫粉不溶于水、微溶于酒精,却易溶于Na2S溶液,发生如下反应:(x-1)S(s)+S2-(aq)?Sx2-(aq)(x≤6),达到平衡后,C(S2-)随温度T的变化如图所示.下列有关说法正确的是( )
硫粉不溶于水、微溶于酒精,却易溶于Na2S溶液,发生如下反应:(x-1)S(s)+S2-(aq)?Sx2-(aq)(x≤6),达到平衡后,C(S2-)随温度T的变化如图所示.下列有关说法正确的是( )
 硫粉不溶于水、微溶于酒精,却易溶于Na2S溶液,发生如下反应:(x-1)S(s)+S2-(aq)?Sx2-(aq)(x≤6),达到平衡后,C(S2-)随温度T的变化如图所示.下列有关说法正确的是( )
硫粉不溶于水、微溶于酒精,却易溶于Na2S溶液,发生如下反应:(x-1)S(s)+S2-(aq)?Sx2-(aq)(x≤6),达到平衡后,C(S2-)随温度T的变化如图所示.下列有关说法正确的是( )| A. | 反应(x-1)S(s)+S2-(aq)?Sx2-(aq)的△H>0 | |
| B. | 该反应的平衡常数随温度的升高而减小 | |
| C. | 其他条件不变时,向平衡后的溶液中再加入硫粉,可使溶液中c(Sx2-)增大 | |
| D. | 依此原理,常温下Cl2在饱和NaCl溶液中的溶解度也比在水中的大 |
10.下列两个反应的类型相同的是( )
| A. | 由乙炔制氯乙烯;甲烷与氯气在光照条件下反应 | |
| B. | 溴乙烷和氢氧化钠乙醇溶液共热;乙醇制得乙烯 | |
| C. | 乙烯使溴的四氯化碳溶液褪色;乙烯使酸性高锰酸钾溶液褪色 | |
| D. | 溴乙烷和氢氧化钠溶液共热;乙烯和氢气反应 |
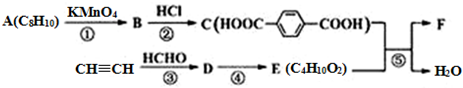
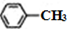 $\stackrel{KMnO_{4}}{→}$
$\stackrel{KMnO_{4}}{→}$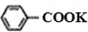
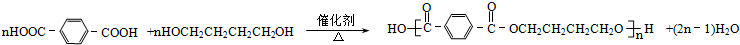 .
.