题目内容
5.磷化铝、磷化锌、磷化钙是我国目前最常见的熏蒸杀虫剂,都能与水或酸反应产生有毒气体膦(PH3),PH3具有较强的还原性,能在空气中自燃.我国粮食卫生标准规定,粮食中磷化物(以PH3计)含量≤0.05mg/kg.某化学兴趣小组的同学通过下列方法对粮食中残留磷化物含量进行研究:
【实验课题】
【实验原理】
5PH3+8KMnO4+12H2SO4═5H3PO4+8MnSO4+4K2SO4+12H2O
2KMnO4+5Na2SO3+3H2SO4═2MnSO4+K2SO4+5Na2SO4+3H2O
【操作流程】
安装蒸馏吸收装置→PH3的产生与吸收→转移褪色→亚硫酸钠标准溶液滴定
【实验装置】
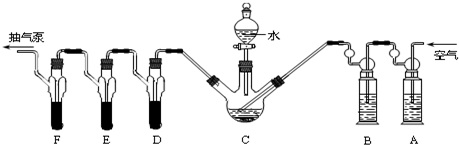
A、D、E、F各装1.00mL浓度为5.00×10-4mol/L的酸性KMnO4溶液,B中装碱性焦性没食子酸(1,2,3-三羟基苯),C中装200g原粮.
(1)实验课题的名称是粮食中残留磷化物的定量测定.
(2)以磷化铝为例,写出磷化物与水反应的化学方程式AlP+3H2O=Al(OH)3↓+PH3↑.
(3)检查上述装置气密性的方法是打开抽气泵抽气,观察各装置中是否有气泡产生.
(4)A中盛装KMnO4溶液是为除去空气中可能含有的(填“氧化性”、“还原性”)还原性气体; B中盛装碱性焦性没食子酸溶液的作用是除去空气中的O2;如去除B装置,则实验中测得的PH3含量将偏低(填偏大、偏小或不变).
(5)将D、E、F三装置中的吸收液、洗涤液一并置于锥形瓶中,加水稀释至25mL,用浓度为2.5×10-4mol/LNa2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为2.12×10-4mg/kg.
分析 (1)PH3具有较强的还原性,可用KMnO4和Na2SO3测定;
(2)磷化铝能与水或酸反应产生有毒气体膦(PH3),与水反应结合水的结构可知磷化铝能与水反应生成氢氧化铝和PH3;
(3)依据连续装置中的压强变化分析判断;
(4)高锰酸钾溶液是强氧化剂可以吸收还原性气体;碱性焦性没食子酸溶液,焦性没食子酸先和碱反应,再和氧气反应可以吸收氧气;若不吸收氧气,PH3会在氧气中燃烧;
(5)依据消耗的亚硫酸钠物质的量结合定量关系计算剩余高锰酸钾,计算吸收PH3需要的高锰酸钾物质的量,进一步计算PH3物质的量,得到PH3含量.
解答 解:(1)磷化铝、磷化锌、磷化钙是我国目前最常见的熏蒸杀虫剂,都能与水或酸反应产生有毒气体膦(PH3),PH3具有较强的还原性,可用KMnO4和Na2SO3测定粮食中残留磷化物含量;安装蒸馏吸收装置,A、D、E、F各装1.00mL浓度为5.00×10-4mol/L的酸性KMnO4溶液,B中装碱性焦性没食子酸(1,2,3-三羟基苯),C中装200g原粮,高锰酸钾溶液是强氧化剂可以吸收空气中的还原性气体;焦性没食子酸先和碱反应,再和氧气反应可以吸收氧气;若不吸收氧气,PH3会在氧气中燃烧,然后用高锰酸钾滴定测定PH3,然后用Na2SO3标准溶液滴定剩余的KMnO4溶液,可得磷化物含量,故答案为:粮食中残留磷化物的定量测定;
(2)依据题干信息,磷化铝和水反应,水解生成PH3和氢氧化铝,反应的化学方程式为:AlP+3H2O=Al(OH)3↓+PH3↑,
故答案为:AlP+3H2O=Al(OH)3↓+PH3↑;
(3)利用连续装置特征,结合气体压强变化,可以利用抽气泵抽气观察各装置中气体的产生,若有气泡冒出,证明气密性完好;
故答案为:打开抽气泵抽气,观察各装置中是否有气泡产生;
(4)依据装置图中装置中的试剂选择分析判断,高锰酸钾溶液是强氧化剂可以吸收空气中的还原性气体;焦性没食子酸先和碱反应,再和氧气反应可以吸收氧气;若不吸收氧气,PH3会在氧气中燃烧,用滴定方法测定的PH3减小,结果偏低;
故答案为:还原性气体;除去空气中的O2;偏低;
(5)加水稀释至25mL,用浓度为2.5×10-4mol/L Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL;依据滴定反应:2KMnO4+5Na2SO3+3H2SO4=2MnSO4+K2SO4+5Na2SO4+3H2O;2KMnO4~5Na2SO3;未反应的高锰酸钾物质的量=0.0110L×2.5×10-4mol/L×$\frac{2}{5}$=1.1×10-6mol;与PH3反应的高锰酸钾物质的量=1.00×10-3mol/L×0.0030L-1.1×10-6mol=2.0×10-6mol;根据反应 5PH3+8KMnO4+12H2SO4=5H3PO4+8MnSO4+4K2SO4+12H2O;得到定量关系为:5PH3~8KMnO4;计算得到PH3物质的量=2.0×10-6mol×$\frac{5}{8}$=1.25×10-6mol,则PH3的质量分数=$\frac{1.25×10-6mol×34g/mo}{0.2kg}$=2.12×10-4g/kg,
故答案为:2.12×10-4.
点评 本题以粮食中残留磷化氢的定量测定为命题背景,考查元素化合物知识氧化还原反应滴定及相关计算,综合考查了水解方程式的书写、非常规装置气密性的检验方法、实验原理的理解和定量测定的有关计算和误差分析等.

| A. | 油脂的氢化是指将不饱和程度较高、熔点较低的液态油,通过催化加氢,可提高饱和度,转化成半固态的脂肪的过程 | |
| B. | 在酸性条件下,蔗糖水解成葡萄糖和果糖,它们都能被溴水氧化 | |
| C. | 氨基酸是两性化合物,只有两个不同氨基酸分子间脱水才能形成肽键 | |
| D. | 蛋白质遇到醋酸铅变性沉淀,加入大量的水,沉淀还可溶解 |
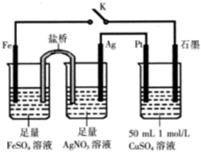
| A. | 盐桥中的电解质可以用KCl | |
| B. | 闭合K,外电路电流方向为Fe电极→石墨电极 | |
| C. | 闭合K,石墨电极上只生成铜 | |
| D. | 导线中流过0.15 mol e-时,加入5.55gCu2(OH)2CO3,CuSO4溶液可恢复原组成 |
| A. | 0.1 mol•L-1的醋酸加水稀释,$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 | |
| B. | 体积、pH均相同的醋酸和盐酸完会溶解等量的镁粉(少量),后者用时少 | |
| C. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 | |
| D. | 常温下,V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
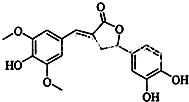
| A. | 分子中含有三种含氧官能团 | |
| B. | 1 mol 该化合物最多能与5mol NaOH反应 | |
| C. | 既可以发生取代反应,又能够发生加成反应 | |
| D. | 能与FeCl3发生显色反应,不能和NaHCO3反应放出CO2 |
| A. | KClO3是氧化剂 | |
| B. | 被氧化与被还原的氯元素的质量比为5:1 | |
| C. | Cl2既是氧化产物又是还原产物 | |
| D. | 0.1mol KClO3 参加反应时有1mol电子转移 |