��Ŀ����
6��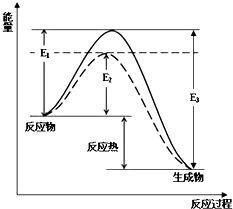 ��1����ҵ�ϳɰ���һ�����淴Ӧ��N2��g��+H2��g��?2NH3��g����ͼ�����߲�����ͨ���ı仯ѧ��Ӧ�е������������ԭ���±�Ϊ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����ɴ˿���֪������T1��573K�����������������=������
��1����ҵ�ϳɰ���һ�����淴Ӧ��N2��g��+H2��g��?2NH3��g����ͼ�����߲�����ͨ���ı仯ѧ��Ӧ�е������������ԭ���±�Ϊ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����ɴ˿���֪������T1��573K�����������������=������ | T/K | T1 | 573 | T3 |
| K | 1.00��107 | 2.54��105 | 1.88��103 |
��3���������ļ�̬��+2��+4�ۣ��ڻ��������ȶ��ļ�̬Ϊ+4�ۣ������Ƶ�SnCl2��ˮ��Һ���˹���SnCl2��ˮ�⣬����Ҫ�������������Sn��
��4������ȼ�Ͳ���ȫȼ��ʱ����CO���������밴���з�Ӧ��ȥCO��2CO��g��=2C��s��+O2��g������֪�÷�Ӧ�ġ�H��0�������������ܷ�ʵ�ֵ����ݣ�����ʵ�֣���Ϊ���H-T��S��0��
��5��Mg��OH��2����þ�Ρ��ͻ���Ϻ���ȼ������Ҫԭ�ϣ�
��֪��a��25��ʱ��KSP[Mg��OH��2]=4.0��10-38��b��Mg��OH��2��s��=MgO��s��+H2O��g����H=+81.5kJ•mol-1��
������������ȷ����BD��
A������±��ˮ�л��Mg��OH��2����ҵ��ѡ��NaOH��������
B��Mg��OH��2������ȼ�������ֽ�����������MgO���ǿ�ȼ��
C���ɼ���Mg��OH��2�õ�MgO���ٵ�����ڵ�MgO�ƽ���þ
D�������£�̼���Ժ�����þ������Ӧ
�����ָʾ�����������ɫ��pH��Χ���£�
| pH | ��8.0 | 8.0��9.6 | ��9.6 |
| ��ɫ | ��ɫ | ��ɫ | ��ɫ |
���� ��1���¶Ⱥ�ƽ�ⳣ����Ĺ�ϵȡ����ƽ�����¶ȵ�Ӱ�������
��2��������⻯��ΪRHx������R����Է�������Ϊa����$\frac{x}{a+x}$=0.077����923x=77a��XΪ�����Ļ��ϼۣ����ۿɵ�x=2��a=24���ʸý����⻯��ΪMgH2��
��3�����Ƶ�SnCl2��ˮ��Һʱ��Ҫ��ֹSn2+��������ˮ�⣻
��4����H-T��S��0ʱ����Ӧ�����Է����У�
��5����A������±��ˮ�л��Mg��OH��2����ҵ��ѡ����ʯ������������
B��Mg��OH��2�ֽ����ȣ���MgO����ȼ�գ�
C��MgO�۵�̫�ߣ���ҵ�ϵ���Ȼ�þ��ȡþ��
D�����������£�̼������þ��Ӧ����þ�Ͷ�����̼��һ����̼��
�ڣ�4��Mg��OH��2�ı�����Һ�е��ܶȻ����㱥����Һ�е�����������Ũ�ȣ����ˮ��Һ�����ӻ�����������Ũ�ȼ���pH��Ȼ���ϱ��������ж���Һ�����ֵ���ɫ��
��� �⣺��1�����ڷ��ȷ�Ӧ���¶����ߣ���ѧƽ�������ƶ�������ƽ�ⳣ����С������T1��573K���ʴ�Ϊ������
��2��������⻯��ΪRHx������R����Է�������Ϊa����$\frac{x}{a+x}$=0.077����923x=77a��XΪ�����Ļ��ϼۣ����ۿɵ�x=2��a=24���ʸý����⻯��ΪMgH2���ʷ�Ӧ����ʽΪ2Mg2Cu+3H2$\frac{\underline{\;\;��\;\;}}{\;}$MgCu2+3MgH2��
�ʴ�Ϊ��2Mg2Cu+3H2$\frac{\underline{\;\;��\;\;}}{\;}$MgCu2+3MgH2��
��3�����Ƶ�SnCl2��ˮ��Һʱ��Ҫ��ֹSn2+��������ˮ�⣬��������������ˮ�⣬����Sn��ֹ���������ʴ�Ϊ�������Sn��
��4����Ӧ2CO��g��=2C��s��+O2��g���ġ�S��0�����H��0�������H-T��S��0����Ӧ�����Է����У��ʴ�Ϊ������ʵ�֣���Ϊ���H-T��S��0��
��5����A������±��ˮ�л��Mg��OH��2����ҵ��ѡ����ʯ��������������A����
B��Mg��OH��2�ֽ����ȣ���MgO����ȼ�գ�����Mg��OH��2������ȼ�������ֽ�����������MgO���ǿ�ȼ���B��ȷ��
C��MgO�۵�̫�ߣ���ҵ�ϵ���Ȼ�þ��ȡþ����C����
D�����¼���̼������þ�Ļ����ʱ�����ɵĶ�����̼��һ����̼�ܲ������뷴Ӧ��ϵ����ʹ��Ӧ���Ͻ��У����̼�����û���þ����D��ȷ��
�ʴ�Ϊ��BD��
��25��ʱ��Mg��OH��2���ܶȻ�Ksp=5.6��10-12�����ݷ�ӦMg��OH��2��s��?Mg2++2OH-�ɵã�c��Mg2+��•c2��OH-��=5.6��10-12��
��c��OH-��=2c��Mg2+��=x����0.5x��x2=5.6��10-12��
��ã�x=2.24��10-4mol/L��
c��H+��=$\frac{1{0}^{-14}}{2.24��1{0}^{-4}}$mol/L=4.5��10-11mol/L��
��Һ��pH=10.4��9.6��������Һ����ɫ��
�ʴ�Ϊ����ɫ��
���� ���⿼��������ˮ�⡢��Ӧ��ѧ��Ӧ�Է����е���������ѧʵ������������ۺ�Ӧ�õ�֪ʶ���Ѷ��еȣ������漰��֪ʶ��϶࣬ȫ�濼����ѧ���ķ�����������������ȷ������������Ϊ���ؼ����ѶȽϴ�

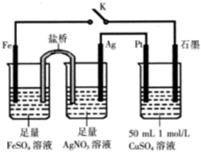
| A�� | �����еĵ���ʿ�����KCl | |
| B�� | �պ�K�����·��������ΪFe�缫��ʯī�缫 | |
| C�� | �պ�K��ʯī�缫��ֻ����ͭ | |
| D�� | ����������0.15 mol e-ʱ������5.55gCu2��OH��2CO3��CuSO4��Һ�ɻָ�ԭ��� |
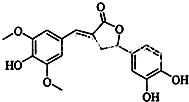
| A�� | �����к������ֺ��������� | |
| B�� | 1 mol �û������������5mol NaOH��Ӧ | |
| C�� | �ȿ��Է���ȡ����Ӧ�����ܹ������ӳɷ�Ӧ | |
| D�� | ����FeCl3������ɫ��Ӧ�����ܺ�NaHCO3��Ӧ�ų�CO2 |
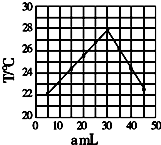 ��amL 0.1mol/LHCl��Һ��bmLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ�������¼��Һ�¶ȣ�ʵ������ͼ��ʵ����ʼ�ձ���a+b=50ml��������������ȷ���ǣ�������
��amL 0.1mol/LHCl��Һ��bmLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ�������¼��Һ�¶ȣ�ʵ������ͼ��ʵ����ʼ�ձ���a+b=50ml��������������ȷ���ǣ�������| A�� | ����ʵ��ʱ�������¶�Ϊ22���϶� | |
| B�� | ��ʵ�������ѧ�ܿ���ת��Ϊ���� | |
| C�� | NaOH��Һ��Ũ��ԼΪ0.1mol/L | |
| D�� | ��ʵ�������ˮ���ɵķ�Ӧ���Ƿ��ȷ�Ӧ |
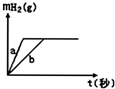
| A�� | ����aΪK��bΪNa | B�� | Ͷ���Na����������K������ | ||
| C�� | Ͷ���Na��Kһ�������� | D�� | ϡ�������һ���Dz������� |
| A�� | KClO3�������� | |
| B�� | �������뱻��ԭ����Ԫ�ص�������Ϊ5��1 | |
| C�� | Cl2���������������ǻ�ԭ���� | |
| D�� | 0.1mol KClO3 �μӷ�Ӧʱ��1mol����ת�� |
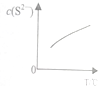 ��۲�����ˮ�����ھƾ���ȴ������Na2S��Һ���������·�Ӧ����x-1��S��s��+S2-��aq��?Sx2-��aq����x��6�����ﵽƽ���C��S2-�����¶�T�ı仯��ͼ��ʾ�������й�˵����ȷ���ǣ�������
��۲�����ˮ�����ھƾ���ȴ������Na2S��Һ���������·�Ӧ����x-1��S��s��+S2-��aq��?Sx2-��aq����x��6�����ﵽƽ���C��S2-�����¶�T�ı仯��ͼ��ʾ�������й�˵����ȷ���ǣ�������| A�� | ��Ӧ��x-1��S��s��+S2-��aq��?Sx2-��aq���ġ�H��0 | |
| B�� | �÷�Ӧ��ƽ�ⳣ�����¶ȵ����߶���С | |
| C�� | ������������ʱ����ƽ������Һ���ټ�����ۣ���ʹ��Һ��c��Sx2-������ | |
| D�� | ����ԭ����������Cl2�ڱ���NaCl��Һ�е��ܽ��Ҳ����ˮ�еĴ� |

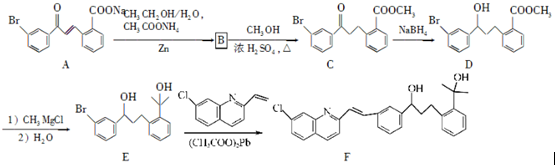 ��ش��������⣺
��ش��������⣺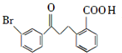 ��
��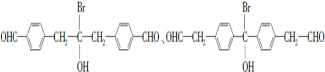 ��
�� Ϊԭ���Ʊ�
Ϊԭ���Ʊ�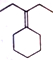 �ĺϳ�·������ͼ�������ܼ������Լ����ã�
�ĺϳ�·������ͼ�������ܼ������Լ����ã�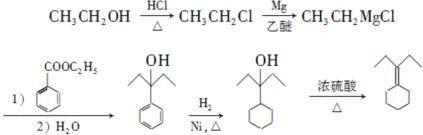 ��
��