题目内容
19.为了测定某碳素钢(假设只含铁和碳)的含碳量,将10.000g钢样完全溶解于过量的热浓硝酸中,产生了0.300mol的气体(假设气体全部逸出,N2O4已折算为NO2).气体用50.00mL 12.00mol/L的NaOH溶液完全吸收后,只生成两种盐,溶液蒸干后得到不含结晶水的固体32.664g.计算:(1)钢样的含碳量;
(2)参加反应的硝酸的物质的量.
分析 (1)若铁与浓硝酸反应生成的完全为二氧化氮,根据反应C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H20、Fe+6HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+3NO2↑+3H2O可知,当C为0时生成气体的量最少,则10g铁完全反应生成二氧化氮的物质的量为:$\frac{10g}{56g/mol}$×3≈0.536mol>0.300mol,所以铁与硝酸反应生成的气体为NO、NO2的混合物;再根据气体用50.00mL 12.00mol/L的NaOH溶液(氢氧化钠远远过量)完全吸收后,只生成两种盐可知,生成的盐为碳酸钠和亚硝酸钠,说明生成的NO、NO2的物质的量相等,设NO、NO2的物质的量都为x,该碳素钢中含有C为y,
根据反应C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H20可知,ymolC与浓硝酸反应生成ymol二氧化碳、4ymol二氧化氮,
铁与浓硝酸反应生成的二氧化氮为:x-4y,根据反应Fe+6HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+3NO2↑+3H2O、Fe+4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+NO↑+2H2O可知,该钢中含有铁的物质的量为:$\frac{3}{2}$x+$\frac{1}{3}$(x-4y),根据该钢的质量可得:①[x+$\frac{1}{3}$(x-4y)]×56+12y=10.00,再根据气体的总物质的量可得:②y+2x=0.3,联立①②计算出x、y,再计算出该钢样的含碳量;
(2)根据(1)计算结果及反应C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H20、Fe+6HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+3NO2↑+3H2O、Fe+4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+NO↑+2H2O计算出反应中消耗硝酸的总物质的量.
解答 解:(1)若铁与浓硝酸反应生成的完全为二氧化氮,根据反应C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H20、Fe+6HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+3NO2↑+3H2O可知,当C为0时生成气体的量最少,则10g铁完全反应生成二氧化氮的物质的量为:$\frac{10g}{56g/mol}$×3≈0.536mol>0.300mol,所以铁与硝酸反应生成的气体为NO、NO2的混合物;再根据气体用50.00mL 12.00mol/L的NaOH溶液(氢氧化钠远远过量)完全吸收后,只生成两种盐可知,生成的盐为碳酸钠和亚硝酸钠,说明生成的NO、NO2的物质的量相等,设NO、NO2的物质的量都为x,该碳素钢中含有C为y,
根据反应C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H20可知,ymolC与浓硝酸反应生成ymol二氧化碳、4ymol二氧化氮,
铁与浓硝酸反应生成的二氧化氮为:x-4y,根据反应Fe+6HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+3NO2↑+3H2O、Fe+4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+NO↑+2H2O可知,该钢中含有铁的物质的量为:$\frac{3}{2}$x+$\frac{1}{3}$(x-4y),根据该钢的质量可得:①[x+$\frac{1}{3}$(x-4y)]×56+12y=10.00,
根据气体的总物质的量可得:②y+2x=0.3,
联立①②解得:x=0.144mol、y=0.012mol,
即:该钢中含有0.012molC,其含碳量为:$\frac{12g/mol×0.012mol}{10.00g}$×100%=1.44%,
答:该钢样的含碳量为1.44%;
(2)0.012molC消耗硝酸的物质的量为:0.012mol×4=0.048mol,
生成0.144molNO消耗硝酸的物质的量为:0.144mol×4=0.576mol,
铁与浓硝酸反应生成二氧化氮的物质的量为:0.144mol-0.012mol×4=0.096mol,反应生成0.096mol二氧化氮消耗硝酸的物质的量为:0.096mol×$\frac{6}{3}$=0.192mol,
所以反应中消耗硝酸的总物质的量为:0.048mol+0.576mol+0.192mol=0.816mol,
答:参加反应的硝酸的物质的量为0.816mol.
点评 本题考查了混合物反应的计算,题目难度较大,根据生成气体的量及生成两种盐判断反应气体组成及生成固体的组成为解答关键,注意明确一氧化氮、二氧化氮与氢氧化钠溶液的反应原理,试题侧重考查学生的分析、理解能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 1 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
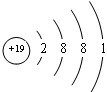 .
.(2)表中某元素能形成两性氢氧化物,写出该两性氢氧化物与⑨的最高价氧化物的水化物反应的离子方程式(OH)3+OH-=AlO2-+2H2O.
(3)④元素与③元素形成化合物的电子式
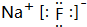 .
.(4)下列说法正确的是E
A.元素④比⑤的金属性强,是因为④在反应中失去的电子数比⑤少
B.③、⑥、⑦三种元素中,③的最高价氧化物的水化物的酸性最强
C.⑦的氢化物的水溶液酸性比⑥强,说明元素⑦的非金属性强
D.晶体⑧在熔化过程中需破坏化学键
E.元素⑦可用于制有机农药,但其难降解、高残留,现在已逐渐被其他农药取代.
(5)⑦元素与⑩元素两者核电荷数之差是18.
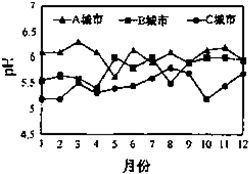
(6)汽车尾气中含有①、②元素的氧化物等有害气体,他们也是造成酸雨危害的主要原因之一.A、B、C三城市全年雨水的月平均pH变化如图2所示,
①受酸雨危害最严重的是:C城市;
②写出由元素②的一种红棕色气体形成酸雨的离子方程式:3NO2+H2O=2H++2NO3-+NO;
③汽车安装尾气催化净化装置,可将上述混合气体转化为无害气体排放,降低对环境的污染.写出该反应的化学方程式2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.催化剂的作用是:加快反应速率.
| A. | 氧化还原原理 | B. | 溶解沉淀原理 | C. | 平衡移动原理 | D. | 物质两性原理 |
| A. | 环烷烃 | B. | 醇类 | C. | 炔烃 | D. | 油脂 |
| A. | 10ml0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | 0.1mol/LpH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-) | |
| D. | c(NH4+)相等的(NH4)2SO4溶液,(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl) |
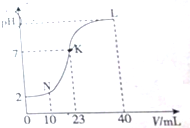
| A. | K点时的溶液:n(A-)=n(M+)=2×10-4 mol | |
| B. | N点时的溶液:2c(M+)=c(A-) | |
| C. | L点时的溶液中一定存在:c(M+)>c(A-)>c(OH-)>c(H+) | |
| D. | 水电离的程度:K>L>N |
| A. | KCl、NaOH | B. | CO2、HCl | C. | CaCl2、NH4NO3 | D. | Na2O2、H2O2 |
 如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:
如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答: