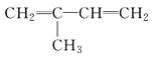题目内容
【题目】短周期元素A、B、D、E的原子序数依次增大,B、E位于同主族,四种元素的一种化合物的结构式如图所示。下列说法不正确的是
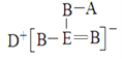
A.B的最简单氢化物的沸点比E的高
B.D和E形成的三核二元化合物的水溶液中,阴、阳离子的浓度之比小于1:2
C.化合物DA的水溶液呈碱性
D.同时含有A、B、D、E四种元素的盐至少有两种
【答案】B
【解析】
短周期元素A、B、D、E的原子序数依次增大,四种元素组成的一种化合物的结构式为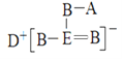 , B与A成键时,B形成两个共价键,位于ⅥA族,B、E位于同主族,则B为O, E为S ,E能够形成4个共价键,有一对配位键,得到D给的一个电子,达到稳定结构; D能够形成+1价阳离子,其原子序数大于O,则D为Na;A只能形成1个共价键,则A位于ⅠA族,结合原子序数大小可知,A为H元素,据此解答。
, B与A成键时,B形成两个共价键,位于ⅥA族,B、E位于同主族,则B为O, E为S ,E能够形成4个共价键,有一对配位键,得到D给的一个电子,达到稳定结构; D能够形成+1价阳离子,其原子序数大于O,则D为Na;A只能形成1个共价键,则A位于ⅠA族,结合原子序数大小可知,A为H元素,据此解答。
A. 根据分析,B、E位于同主族,属于O和S,B的最简单氢化物是水,分子中含有氢键,E的最简单氢化物是硫化氢,水的沸点高于硫化氢的沸点,故A正确;
B.D为Na,E为S, D和E形成的三核二元化合物是Na2S,Na2S是强碱弱酸盐,S2-水解生成HS-和OH-,溶液中阴离子的浓度增大,阴、阳离子的浓度之比大于1:2,故B错误;
C.A为H元素,D为Na;化合物DA为NaH,可与水反应生成氢氧化钠和氢气,其水溶液呈碱性,故C正确;
D.A为H元素,B为O;D为Na;E为S,同时含有A、B、D、E四种元素的盐有NaHSO4或NaHSO3,至少有两种,故D正确;
答案选B。

 名校课堂系列答案
名校课堂系列答案【题目】部分等电子体类型、代表物质及对应的空间构型如表所示:
等电子类型 | 代表物质 | 空间构型 |
四原子24电子等电子体 | SO3 | 平面三角形 |
四原子26电子等电子体 | SO32- | 三角锥形 |
五原子32电子等电子体 | CCl4 | 四面体形 |
六原子40电子等电子体 | PCl5 | 三角双锥形 |
七原子48电子等电子体 | SF6 | 八面体形 |
请回答下列问题。
(1)请写出下列离子的空间构型:
![]() ____________________,
____________________,![]() ____________________,
____________________,![]() ____________________。
____________________。
(2)由第2周期元素原子构成,与F2互为等电子体的离子是__________。
(3)![]() 的空间构型如图1所示,请再按照图1的表示方法在图2中表示出
的空间构型如图1所示,请再按照图1的表示方法在图2中表示出![]() 分子中O、S、F原子的空间位置。已知
分子中O、S、F原子的空间位置。已知![]() 分子中O、S间为共价双键,S、F间为共价单键。__________。
分子中O、S间为共价双键,S、F间为共价单键。__________。

【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取M g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取50.00 mL上述溶液→加入足量的盐酸酸化的BaCl2溶液→操作I→洗涤→操作Ⅱ→称量,得到沉淀的质量为m1 g
方案Ⅱ:取50.00 mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。
实验中所记录的数据如下表:
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
待测溶液体积/mL | 50.00 | 50.00 | 50.00 | 50.00 |
滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
滴定管末读数/mL | 20.95 | 21.20 | 20.15 | 21.20 |
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管、药匙和_______、________。
(2)操作I为______________,操作Ⅱ为______________。
(3)在方案Ⅱ中滴定终点的判断方法是_______________________________。
(4)在方案Ⅱ中发生的离子反应方程式为____________________________。
(5)根据方案Ⅱ所提供的数据,计算Na2SO3的纯度为___________。(写成分数形式)
(6)方案Ⅱ中氧化还原滴定过程中,导致待测液Na2SO3浓度变小的是_____(填序号)。
a.用碱式滴定管量取50mL待测液过程时,开始仰视,滴定结束时俯视
b.用碱式滴定管量取50mL待测液过程时,一开始有气泡,滴定结束后没气泡
c.酸式滴定管用蒸馏水润洗后,没有用酸性KMnO4溶液多次润洗
d.锥形瓶用蒸馏水润洗后,直接装50.00mL的待测液
e.滴定过程时,开始时平视,滴定结束时仰视