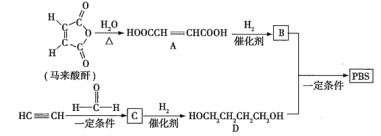
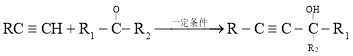
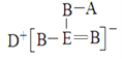题目内容
【题目】配制250mL一定物质的量浓度的盐酸,并用该盐酸滴定未知浓度的NaOH溶液,下列实验操作或说法错误的是
A.实验前,容量瓶和酸式滴定管都需要检查是否漏液
B.若NaOH溶液因久置而变质(含少量Na2CO3),用甲基橙作指示剂,对滴定结果无影响
C.若配制盐酸标准溶液定容时俯视刻度线,则所测定NaOH溶液的浓度偏小
D.当最后一滴盐酸标准液滴入锥形瓶中,溶液颜色由黄色变为橙色时,即达滴定终点
【答案】D
【解析】
A.容量瓶有瓶塞,配制时需要摇匀,所以使用前必须检查是否漏水;滴定管有旋塞或者橡胶管,使用前必须检查是否漏液,故A正确;
B.甲基橙变色的PH范围是3.14.4,用甲基橙作指示剂滴定后溶液呈酸性,滴定时Na2CO3全部反应;
①2NaOH+CO2=Na2CO3+H2ONa2CO3+2HCl=2NaCl+CO2↑+H2O2molNaOH反应生成1molNa2CO3,滴定时消耗2molHCl,②NaOH+HCl=NaCl+H2O,2molNaOH滴定时消耗2molHCl;可知NaOH转变为Na2CO3,对盐酸浓度的测定结果无影响,故B正确;
C.若配制盐酸标准溶液定容时俯视刻度线,会导致盐酸的体积偏小,故n盐酸的偏小,根据c酸V酸=c碱V碱,c酸=![]() ,所测定NaOH溶液的浓度偏小,故C正确;
,所测定NaOH溶液的浓度偏小,故C正确;
D.当最后一滴盐酸标准液滴入锥形瓶中,溶液颜色由黄色变为红色时,且半分钟不变色,即达滴定终点,故D错误;
答案选D。

【题目】下表是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是( )
元素 | A | B | C | D | E |
最低化合价 | -4 | -2 | -1 | -2 | -1 |
电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
A.C、D、E的简单氢化物的稳定性:C>D>E
B.元素A的原子最外层中无自旋状态相同的电子
C.元素B、C之间不可能形成化合物
D.与元素B同周期且在该周期中第一电离能最小的元素的单质能与![]() 发生置换反应
发生置换反应
【题目】高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:
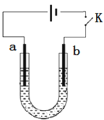
c(NaOH) | 阴极现象 | 阳极现象 |
1 mol·L-1 | 产生无色气体 | 产生无色气体,10min内溶液颜色无明显变化 |
10 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,3min后溶液变为浅紫红色,随后逐渐加深 |
15 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,1min后溶液变为浅紫红色,随后逐渐加深 |
下列说法正确的是( )
A.a为石墨,b为铁钉
B.阴极主要发生反应 4OH--4e-== O2↑+ 2H2O
C.高浓度的NaOH溶液,有利于发生Fe-6e-+ 8OH-== FeO42-+ 4H2O
D.制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体