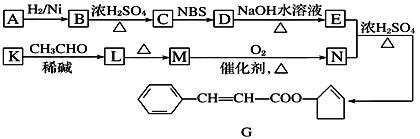
题目内容
【题目】(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是__。
A.KMnO4 B.H2O2 C.Cl2水 D.HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的__。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,已知Ksp(AmBn)=[c(An+)]m.[c(Bm-)]n,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为__,Fe3+完全沉淀时溶液的pH为__,通过计算确定上述方案__(填“可行”或“不可行”)。(提示:lg2=0.3)
【答案】B CD 4 3.3 可行
【解析】
(1)除杂质至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质,四个选项中,只有双氧水氧化后生成水,双氧水受热见光易分解,没有多余杂质,故选B;
调整溶液的pH时,加入的物质不能引进新的杂质粒子,氢氧化钠中含有钠离子,氨水反应后生成铵根离子,所以氢氧化钠和氨水能引进新的杂质离子,CuO粉末、Cu(OH)2悬浊液反应后生成铜离子和水而不引进新的杂质离子,故选CD。
故答案为:B;CD;
(2)Cu(OH)2的溶度积Ksp=3.0×10-20,溶液中CuSO4的浓度为3.0mol·L-1,c(Cu2+)=3.0mol·L-1;依据溶度积常数c(Cu2+)×c2(OH-)=3.0×10-20 ;c2(OH-)=3×10-20÷3.0=10-20;得到c(OH-)=10-10mol·L-1,依据水溶液中的离子积c(H+)×c(OH-)=10-14;c(H+)=10-4mol·L-1,溶液pH=4,则Cu(OH)2开始沉淀时溶液的pH为4;
残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,Fe(OH)3的溶度积Ksp=8.0×10-38,c(Fe3+)×c3(OH-)=8.0×10-38;c3(OH-)=![]() =8.0×10-33;c(OH-)=2×10-11mol·L-1;水溶液中的离子积c(H+)×c(OH-)=10-14;c(H+)=5×10-4mol·L-1,则pH=3.3;
=8.0×10-33;c(OH-)=2×10-11mol·L-1;水溶液中的离子积c(H+)×c(OH-)=10-14;c(H+)=5×10-4mol·L-1,则pH=3.3;
通过计算可知pH=4能达到除去Fe3+而不损失Cu2+的目的,则方案可行。
故答案为:4;3.3;可行。