题目内容
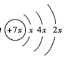
【题目】有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A元素原子最外层p能级的电子数等于次外层的电子总数,C元素原子最外层中有2个未成对电子。已知C、D、E元素原子核内的质子数均与中子数相等,且C元素可分别与A、B、D、E生成![]() 型化合物,在
型化合物,在![]() 中,D与C的质量比为7:8,在
中,D与C的质量比为7:8,在![]() 中,E与C的质量比为1:1。
中,E与C的质量比为1:1。
请回答下列问题:
(1)写出A、E两种元素的元素符号:A ____________ 、E ____________ 。
(2)写出D元素原子的核外电子排布式: ____________ 。
(3)指出E在元素周期表中的位置: ____________ 。
(4)比较A、B、C三种元素的第一电离能的大小: ____________ (填元素符号,下同)。
(5)比较D元素和E元素的电负性的相对大小: ____________ 。
【答案】C S ls22s22p63s23p2 第三周期第ⅥA族 C<O<N Si<S
【解析】
A元素原子最外层p能级的电子数等于次外层的电子总数,则A为C元素;A、B、C属于同一周期,C元素原子最外层中有2个未成对电子,则C为O;在![]() 中,D与C的质量比为7:8,则D的相对原子质量为28,即D为Si元素;在
中,D与C的质量比为7:8,则D的相对原子质量为28,即D为Si元素;在![]() 中,E与C的质量比为1:1,则E的相对原子质量为32,即E为S元素;剩下B为N元素;综上:A为C元素,B为N元素,C为O元素,D为Si元素,E为S元素。
中,E与C的质量比为1:1,则E的相对原子质量为32,即E为S元素;剩下B为N元素;综上:A为C元素,B为N元素,C为O元素,D为Si元素,E为S元素。
(1)A、E两种元素的元素符号:A为C元素,E为S元素;
(2)D元素为镁,核电荷数为12,原子的核外电子排布式:ls22s22p63s23p2;
(3)E为硫元素,核电荷数为16,元素周期表中的位置:第三周期第ⅥA族;
(4)由于N原子2p轨道半充满,结合电离能在同周期时,越往右越大,因而A、B、C三种元素的第一电离能的大小:C<O<N;
(5)电负性同周期时,越往右越大,D元素和E元素的电负性的相对大小:Si<S。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案【题目】下表是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是( )
元素 | A | B | C | D | E |
最低化合价 | -4 | -2 | -1 | -2 | -1 |
电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
A.C、D、E的简单氢化物的稳定性:C>D>E
B.元素A的原子最外层中无自旋状态相同的电子
C.元素B、C之间不可能形成化合物
D.与元素B同周期且在该周期中第一电离能最小的元素的单质能与![]() 发生置换反应
发生置换反应