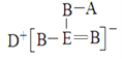题目内容
【题目】下列说法正确的是( )
A.熔融状态下硫酸氢钾中的离子键、共价键均被破坏,形成定向移动的离子,因而能够导电
B.F2、Cl2、Br2、I2的熔沸点逐渐升高,是因为分子间作用力越来越大
C.NH3和Cl2两种分子中,每个原子的最外层都达到8电子的稳定结构
D.HF、HCl、HBr、HI的稳定性逐渐减弱,沸点逐渐升高
【答案】B
【解析】
A.熔融状态下硫酸氢钾的电离方程式为![]() ,形成自由移动的离子,具有导电性,共价键不被破坏,故A错误;
,形成自由移动的离子,具有导电性,共价键不被破坏,故A错误;
B.组成和结构相似的物质,相对分子质量越大,范德华力越大,熔沸点越大,则F2、Cl2、Br2、I2的熔、沸点逐渐升高,是因为分子间作用力越来越大,故B正确;
C.NH3中H原子为2电子稳定结构,N原子为8电子稳定结构,Cl2分子中Cl原子的最外层具有8电子稳定结构,故C错误;
D.随着原子序数的增大,单质得电子能力逐渐减弱,其阴离子失电子能力逐渐增强,所以HF、HCl、HBr、HI稳定性逐渐减弱;组成和结构相似的物质,相对分子质量越大,范德华力越大,熔沸点越大,但HF分子间有氢键,所以HF、HCl、HBr、HI沸点最高的是HF,故D错误:
故选B。

【题目】高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:
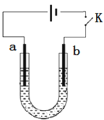
c(NaOH) | 阴极现象 | 阳极现象 |
1 mol·L-1 | 产生无色气体 | 产生无色气体,10min内溶液颜色无明显变化 |
10 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,3min后溶液变为浅紫红色,随后逐渐加深 |
15 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,1min后溶液变为浅紫红色,随后逐渐加深 |
下列说法正确的是( )
A.a为石墨,b为铁钉
B.阴极主要发生反应 4OH--4e-== O2↑+ 2H2O
C.高浓度的NaOH溶液,有利于发生Fe-6e-+ 8OH-== FeO42-+ 4H2O
D.制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体