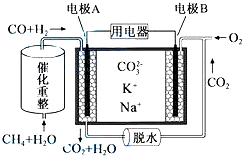
题目内容
18.现有以下物质:①NaCl晶体 ②干冰 ③熔融的KNO3 ④石墨 ⑤BaSO4固体 ⑥蔗糖 ⑦酒精,请回答以下问题(填序号):(1)能导电的是③④;
(2)属于非电解质的是②⑥⑦;
(3)属于电解质的是①③⑤.
分析 (1)根据导电原因、电解质、非电解质的定义判断,能导电的物质必须含有自由电子或自由离子;
(2)非电解质:在水溶液里或熔融状态下都不能导电的化合物;
(3)电解质:在水溶液里或熔融状态下能导电的化合物.
解答 解:①NaCl晶体不能导电,溶于水或熔融状态下能导电,属于电解质;
②干冰是二氧化碳的固体,不能导电,属于非电解质;
③熔融的KNO3能导电,属于电解质;
④石墨是碳的单质,能导电,但既不是电解质也不是非电解质;
⑤BaSO4固体不能导电,熔融状态下能导电,属于电解质;
⑥蔗糖不能导电,属于非电解质;
⑦酒精不能导电,属于非电解质,
故答案为:③④;②⑥⑦;①③⑤.
点评 本题考查电解质和非电解质,明确概念的要点即可解答,抓住化合物来分析是解答的关键,并注意导电的原因来解答.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
8.化学与社会、生活密切相关,对下列现象或解释正确的是( )
| 选项 | 应用 | 解释 |
| A | 日常生活中铝制品具有一定的抗腐蚀性 | 铝常温下不能与氧气反应 |
| B | 用氢氟酸雕刻玻璃 | 氢氟酸能与玻璃中某些成分反应 |
| C | 用酒精进行消毒 | 酒精容易挥发 |
| D | 汽车尾气中含有氮的氧化物 | 汽油中含有氮元素 |
| A. | A | B. | B | C. | C | D. | D |
9.能大量共存于同一种溶液中的一组离子是( )
| A. | Al3+,Cl-,K+,OH- | B. | H+,Na+,SO42-,S2- | ||
| C. | Na+,Ca2+,HCO3-,OH- | D. | Mg2+,H+,SO42-,NO3- |
6.下列各组分子中,中心原子均采取sp3不等性杂化的是( )
| A. | PCl3、NH3 | B. | BF3、H2O | C. | CCl4、H2S | D. | BeCl2、BF3 |
13.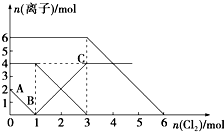 已知:2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中,不正确的是( )
已知:2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中,不正确的是( )
 已知:2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中,不正确的是( )
已知:2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中,不正确的是( )| A. | 还原性:I->Fe2+>Br- | |
| B. | 原混合溶液中FeBr2的物质的量为6 mol | |
| C. | 当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| D. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
3.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| B. | 常温下,在18g18O2中含有NA个氧原子 | |
| C. | 1 mol乙烷中含有C一H的键数为7×6.02×l023 mol-1 | |
| D. | 1mol-OH所含的电子数目为7NA |
10.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br- | |
| B. | 常温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液:Fe2+、Mg2+、NO${\;}_{3}^{-}$、Cl- | |
| C. | 含有大量Al3+的溶液:Na+、Cl-、AlO${\;}_{2}^{-}$、OH- | |
| D. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO${\;}_{4}^{2-}$、S2-、SO${\;}_{3}^{2-}$ |
8.常温下,下列各组离子一定能大量共存的是( )
| A. | c(OH-)=10-12 mol/L的溶液:K+、Ba2+、Cl-、Br - | |
| B. | 滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| C. | c(OH-)/c(H+)=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| D. | 由水电离的c(H+)=1.0×10-13 mol/L的溶液中:K+、NH4+、AlO2-、HCO3- |