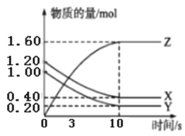
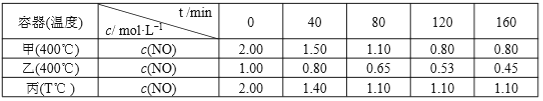
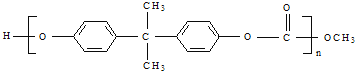
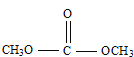题目内容
【题目】NaOH 溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A 的 Ka1=1.1×103 ,Ka2=3.9×106)溶液, 混合溶液的相对导电能力变化曲线如图所示,其中b 点为反应终点。下列叙述错误的是( )
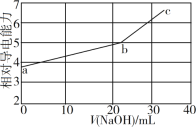
A.a 点溶液 pH<7
B.Na+与A2的导电能力之和大于 HA
C.b 点溶液中:c(H+)+c(HA-) +c(H2A)=c (OH-)
D.c 点 溶 液 中 :c(Na+)>c(K+)> c(A2)>c(OH)>c(H+)
【答案】C
【解析】
A. a 点溶液为邻苯二甲酸氢钾溶液,Ka2=3.9×106,c(H+)≈2×103mol/L,pH<7,A正确;
B. a点和b点K+的物质的量相同,K+的物质的量浓度变化不明显,HA-转化为A2-,b点导电性强于a点,说明Na+和A2-的导电能力强于HA-,B正确;
C. b 点溶液中:A2+H2O![]() HA-+OH-、HA-+H2O
HA-+OH-、HA-+H2O![]() H2A+OH-、H2O
H2A+OH-、H2O![]() H++OH-,所以
H++OH-,所以
c(H+)+c(HA-) +2c(H2A)=c (OH-),C错误;
D. 在b点,溶质为KNaA,c(Na+)=c(K+)=c(A2),考虑到A2水解,所以其浓度减小;至c点,由于a、b间加入NaOH的体积约为22mL,而b、c间加入的NaOH约为10mL,所以c(A2)>c(OH),从而得出c点溶液中,c(Na+)>c(K+)> c(A2)>c(OH)>c(H+),D正确。
故选C。

【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
ⅠA | 0 | ||||||||
1 | ① | ⅡA | …… | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | |||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ||||||||
(1)②元素简单氢化物的电子式是________________________。
(2)③、④、⑤、⑦元素的离子半径由大到小的顺序为______________。
(3)⑥元素的名称为_______________,举出⑥单质的一个应用____________。
(4)上述所有元素中最高价氧化物对应的水化物的酸性最强的是_____________, 写出一个能证明⑧比⑦非金属性强的一个离子反应方程式___________________。
(5)有两种化合物A和B都由①③④⑦四种元素组成。若A与B在水溶液中能发生离子反应,则该反应的离子方程式为____________。
(6)⑨与④的原子序数之差为________。
【题目】下表为元素周期表的一部分,请参照元素①~⑩在表中的位置,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的元素的原子结构示意图为___,形成的单质是半导体的是___(填元素名称)。
(2)⑥与⑨形成的化合物的电子式为___,①与②形成的最简单化合物的结构式为___。
(3
(4)气态氢化物最稳定的是___(填化学式),②、③、⑧的原子半径最小是__(填素符号)。
(5)④与⑧形成的化合物的属于___(填“离子化合物”或“共价化合物”),该晶体属于___晶体(填“离子”、“分子”、“原子”)。