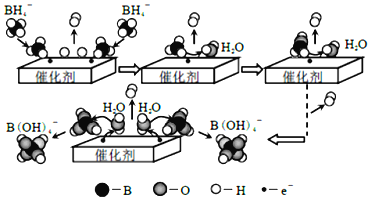
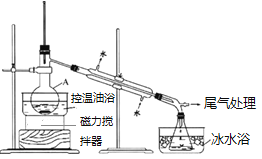
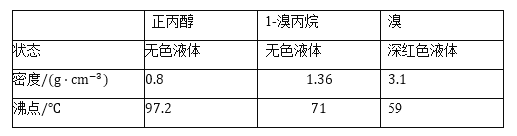
题目内容
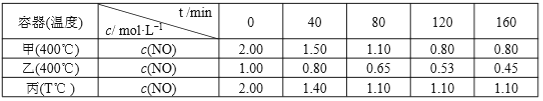
【题目】在甲、乙、丙三个恒温恒容的密闭容器中,分别加入足量活性炭和一定量的 NO,进行反应C(s)+2NO(g) ![]() N2(g)+CO2(g), 测得各容器中 c(NO)随反应时间 t 的变化情况如下表所示,下列说法正确的是( )
N2(g)+CO2(g), 测得各容器中 c(NO)随反应时间 t 的变化情况如下表所示,下列说法正确的是( )
A.达到平衡状态时,2v 正(NO)= v 逆(N2)
B.活性炭的质量不再改变不能说明反应已达平衡状态
C.丙容器中,从反应开始到建立平衡时的平均反应速率为 v (NO) >0.01125mol·L-1·min-1
D.由表格数据可知:T<400℃
【答案】C
【解析】
A. 达到平衡状态时, v 正(NO)=2 v 逆(N2),A错误。
B. 活性炭的质量不再改变时,能说明反应已达平衡状态,B错误。
C. 通过与甲容器进行比较可以发现,丙容器中,反应达平衡的时间短、且反应物的转化率低,说明丙容器中反应温度比甲高,升高温度平衡逆向移动,说明正反应放热。从反应开始到建立平衡时的平均反应速率为 v (NO) =![]() 0.01125mol·L-1·min-1。由于反应放热,溶液的温度升高,所以反应速率比计算值要大,C正确。
0.01125mol·L-1·min-1。由于反应放热,溶液的温度升高,所以反应速率比计算值要大,C正确。
D. 由C的分析可知,丙容器相当于甲容器升温,所以T>400℃,D错误。
故选C。

 开心蛙状元测试卷系列答案
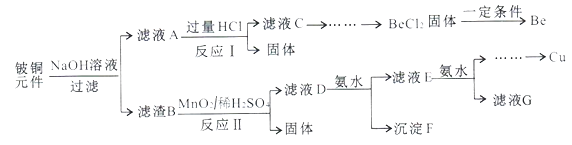
开心蛙状元测试卷系列答案【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工业流程如下:
已知:i.铍、铝元素化学性质相似能形成BeO22-;ii.常温下部分难溶物的溶度积常数如下表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)用NaOH溶液溶解铍铜元件步骤中提高溶解率的措施是_______。(至少写出两种)滤液A的主要成分除NaOH外,还有_____(填化学式)。
(2)写出反应I中含铍化合物与过量盐酸反应的离子方程式_______,写出反应I中生成固体的化学方程式:________。
(3)滤液C中含NaCl、BeCl2和少量HCl。为提纯BeCl2,最合理的实验步骤顺序为____(填字母)。
a.加入过量的氨水 b.通入过量的CO2 c.加入过量的NaOH
d.加入适量的HCl e.洗涤 f.过滤
(4)MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应II中CuS发生反应的化学方程式:______。
(5)该小组从1kg该种旧铍铜元件中回收得到433g Cu,则该流程Cu的产率为_______(保留三位有效数字)。