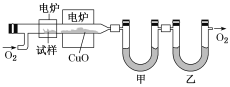
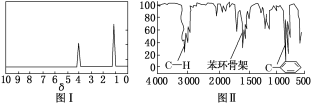
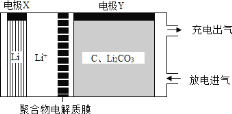
题目内容
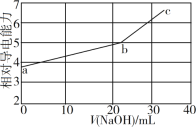
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列说法正确的是( )
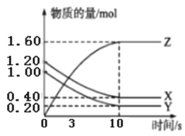
A.该反应的化学方程式为3X+Y![]() 2Z
2Z
B.3s时,正逆反应速率相等
C.平衡时X的浓度为0.40mol/L
D.10s时,该反应达到了最大限度
【答案】D
【解析】
A.据图可知X,Y的物质的量减少,应为反应物,Z的物质的量增加,应为生成物,相同时间内△n(X):△n(Y):△n(Z)=1:1:2,同一反应不同物质的反应速率之比等于计量数之比,所以反应方程式应为X+Y![]() 2Z,故A错误;
2Z,故A错误;
B.3s后各物质的物质的量依然发生改变,即此时反应还未达到平衡,正逆反应速率不相等,故B错误;
C.平衡时X的物质的量为0.4mol,容器容积为2L,所以浓度为0.2mol/L,故C错误;
D.10s后各物质的物质的量不再改变,说明此时反应达到平衡,即达到最大限度,故D正确;
故答案为D。

 阅读快车系列答案
阅读快车系列答案【题目】NF3(三氟化氮)在常温常压下是无色、无味的气体,是微电子工业中一种优良的等离子蚀刻气体。回答下列问题:
(1)NF3的电子式为______,N元素的化合价为______。
(2)F2与NH3直接反应生成NF3的化学方程式为______。
(3)实验室模拟工业上利用电解熔融NH4HF2(NH4FHF)法制取NF3,阳极为以Ni为基本材料的合金(内含其他金属,忽略镍及其他金属的反应),阴极为碳素钢,电解废液可回收再利用。
①电解时NF3在______极生成;阴极产生的气体是______(填化学式)。
②电解后废液(含Ni少量Fe和Cu的单质及NH4HF2等)可经如下流程进行回收再利用:
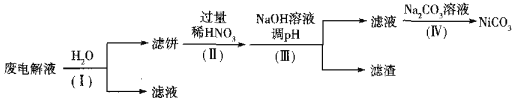
已知该实验条件下,部分金属离子开始沉淀与沉淀完全的pH如下表
金属离子 | Ni2+ | Fe2+ | Cu2+ | Fe3+ |
开始沉淀时的pH | 7.2 | 7.0 | 4.7 | 1.9 |
沉淀完全时的pH | 9.2 | 9.0 | 6.7 | 3.2 |
步骤I的目的是______;步骤Ⅱ滤饼中Ni溶于硝酸的离子方程式为______(HNO3的还原产物为NO);步骤Ⅲ调节pH时,理论上pH应控制的范围是______。
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工业流程如下:
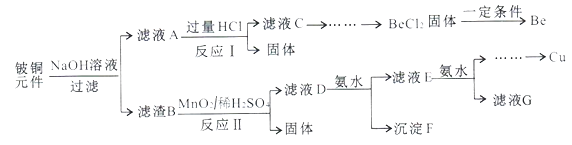
已知:i.铍、铝元素化学性质相似能形成BeO22-;ii.常温下部分难溶物的溶度积常数如下表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)用NaOH溶液溶解铍铜元件步骤中提高溶解率的措施是_______。(至少写出两种)滤液A的主要成分除NaOH外,还有_____(填化学式)。
(2)写出反应I中含铍化合物与过量盐酸反应的离子方程式_______,写出反应I中生成固体的化学方程式:________。
(3)滤液C中含NaCl、BeCl2和少量HCl。为提纯BeCl2,最合理的实验步骤顺序为____(填字母)。
a.加入过量的氨水 b.通入过量的CO2 c.加入过量的NaOH
d.加入适量的HCl e.洗涤 f.过滤
(4)MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应II中CuS发生反应的化学方程式:______。
(5)该小组从1kg该种旧铍铜元件中回收得到433g Cu,则该流程Cu的产率为_______(保留三位有效数字)。