题目内容
15.下表为元素周期表的一部分,元素①-⑧在表中的位置,用化学用语回答下列问题: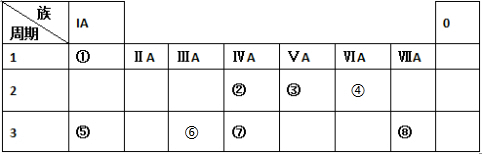
(1)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O.
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3.
(3)①和④两种元素的原子按1:1组成的常见液态化合物为H2O2,该化合物所含的化学键类型为共价键,写出该化合物的电子式
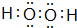 .
.(4)⑥和⑧形成的化合物属于共价化合物.(填“离子”或“共价”)
(5)画出⑤的简单离子的结构示意图
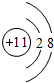 .
.
分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)非金属性越强,最高价含氧酸的酸性越强;
(3)①和④两种元素的原子按1:1组成的常见液态化合物为H2O2,属于共价化合物,分子中氧原子之间形成1对共用电子对,氧原子与氢原子之间形成1对共用电子对;
(4)⑥和⑧形成的化合物为AlCl3,属于共价化合物;
(5)⑤的简单离子为Na+,质子数为11,核外电子数为10,有个电子层,各层电子数为2、8.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Al>O,故答案为:Na>Al>O;
(2)同周期自左而右非金属性增强、同主族自上而下非金属性减弱,故非金属性,N>C>Si,非金属性越强,最高价含氧酸的酸性越强,故酸性:HNO3>H2CO3>H2SiO3,故答案为:HNO3>H2CO3>H2SiO3;
(3)①和④两种元素的原子按1:1组成的常见液态化合物为H2O2,属于共价化合物,含有共价键,分子中氧原子之间形成1对共用电子对,氧原子与氢原子之间形成1对共用电子对,电子式为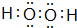 ,
,
故答案为:H2O2;共价键;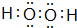 ;
;
(4)⑥和⑧形成的化合物为AlCl3,属于共价化合物,故答案为:共价;
(5)⑤的简单离子为Na+,质子数为11,核外电子数为10,有个电子层,各层电子数为2、8,离子结构示意图为: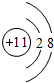 ,故答案为:
,故答案为: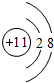 .
.
点评 本题考查元素周期表和元素周期律,比较基础,注意对元素周期表的整体把握与元素周期律的理解.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
18.下列关于丙炔(CH3-C≡CH)的说法正确的是( )
| A. | 丙炔分子中不存在非极性键 | |
| B. | 丙炔分子中3个碳原子都是sp3杂化 | |
| C. | 丙炔分子中所有的原子都在同一直线上 | |
| D. | 丙炔分子中σ键与π键的个数比为3:1 |
6.下列关于元素周期表和元素周期律的说法不正确的是( )
| A. | 从氟到碘,其氢化物的稳定性逐渐减弱 | |
| B. | 氧与硫为同主族元素,氧比硫的原子半径小,氧比硫的非金属性强 | |
| C. | 第三周期从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强 | |
| D. | 因为铝原子比钠原子失去电子数目多,所以铝比钠的还原性强 |
10.若从溴水中把溴萃取出来,可选用的萃取剂是( )
| A. | 水 | B. | 无水酒精 | C. | 四氯化碳 | D. | 氢氧化钠溶液 |
20.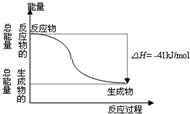 CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )
CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )
 CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )
CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )| A. | 1mol CO2(g)和1mol H2(g)反应生成1molCO(g)和1mol H2O(g)要放出41kJ热量 | |
| B. | 该反应为放热反应 | |
| C. | 反应的热化学方程式是:CO(g)+H2O (g)=CO2(g)+H2(g)△H=+41kJ/mol | |
| D. | CO(g)与H2O(g)所具有的总能量小于CO2(g)与H2(g)所具有的总能量 |
7.某溶液与Al反应能放出H2,下列离子在该溶液中一定能大量共存的是( )
| A. | K+、Ca2+、HCO3-、Cl- | B. | Na+、K+、Cl-、SO42- | ||
| C. | NH4+、K+、Cl-、SO32- | D. | K+、Cl-、NO3-、SO42- |
4.下列实验操作正确的是( )
| A. | 实验室制乙烯:将乙醇和浓H2SO4按1:3(体积比)混合(放碎瓷片),迅速升温至140℃ | |
| B. | 实验室制硝基苯:试剂顺序--先加浓H2SO4,再加浓HNO3混合冷却后,最后加苯 | |
| C. | 检验卤代烃消去反应的有机产物:1-溴丙烷和NaOH的乙醇溶液混合后加热,将产生的蒸汽直接通入酸性高锰酸钾溶液,观察是否褪色 | |
| D. | 鉴别矿物油和植物油:向汽油和植物油中分别加入一定量NaOH溶液加热振荡,观察油层是否消失或变薄 |
5.下列正确的是( )
| A. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | |
| B. | SO2、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| C. | pH=1的溶液中能大量共存的离子组:Fe2+、NO3-、SO42-、Na+ | |
| D. | NO可用于某些疾病的治疗 |
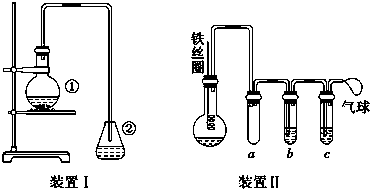
 .
. 与Br2,要想得到纯净的产物,可用NaOH溶液或水试剂洗涤.
与Br2,要想得到纯净的产物,可用NaOH溶液或水试剂洗涤.