题目内容
4.下列有关物质的性质、反应现象的描述及其原理解释均正确,且符合因果关系的是( )| 选项 | 物质的性质或反应现象 | 原理解释 |
| A | SO2通入溴水,溴水褪色 | SO2有漂白性 |
| B | 碱性:NaOH>Al(OH)3 | 金属性:Na>Al |
| C | 白磷比N2的性质活泼 | 非金属性:P>N |
| D | 少量Na投入CuSO4溶液中,Na可以置换出Cu | 活泼性:Na>Cu |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化硫具有还原性,能被强氧化剂氧化;
B.元素的非金属性越强,其最高价氧化物的水化物碱性越强;
C.氮气中含有N≡N,键能大,分子稳定;
D.钠和盐溶液反应时先和水反应,生成的NaOH再和盐发生复分解反应.
解答 解:A.溴具有强氧化性,二氧化硫具有还原性,所以二氧化硫能将溴还原而使溴水褪色,二氧化硫体现还原性,所以原理解释错误,故A错误;
B.元素的非金属性越强,其最高价氧化物的水化物碱性越强,所以碱性:NaOH>Al(OH)3,则金属性Na>Al,反应现象或物质的性质及原理解释都正确,故B正确;
C.氮气中含有N≡N,键能大,分子稳定,所以氮元素的非金属性比磷元素的非金属性强,但N2很稳定,原理解释错误,故C错误;
D.钠性质很活泼,所以钠和硫酸铜溶液混合时先和水反应生成NaOH,生成的NaOH再和硫酸铜发生复分解反应生成氢氧化铜沉淀,所以得不到Cu单质,物质性质或反应现象错误,故D错误;
故选B.
点评 本题考查化学实验方案评价,涉及金属性强弱判断、非金属性强弱判断、二氧化硫的性质等知识点,明确反应原理是解本题关键,易错选项是C,注意二氧化硫漂白性和还原性的区别.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
15.下列关于铷的叙述中正确的是( )
| A. | 硝酸铷是离子化合物 | |
| B. | 在钠、钾、铷三种单质中,铷的熔点最高 | |
| C. | 氢氧化铷是弱碱 | |
| D. | 它位于周期表的第四周期、第ⅠA族 |
9.近年来科学家发现铝的超原子结构Al13和Al14,Al13和Al14的性质与元素周期表中某些主族元素的性质相似,当这类超原子具有40个价电子(对于主族元素的原子,外围电子又称为价电子)时最稳定,在质谱仪上可检测到稳定的Al13-、Al142+.下列说法中错误的是( )
| A. | Al13与Al14互为同素异形体 | |
| B. | Al13超原子中Al原子间是通过离子键结合的 | |
| C. | Al14与氢碘酸反应的化学方程式可表示为:Al14+2HI=Al14I2+H2↑ | |
| D. | Al13在一定条件下能和镁作用生成Mg(Al13)2 |
13.有两种金属的合金10.5克,与足量稀硫酸反应后,产生的气体在标况下占体积11.2L,则组成该合金的元素可能是( )
| A. | Mg和Al | B. | Fe和Zn | C. | Mg和Cu | D. | Na和Zn |
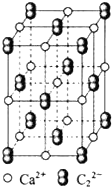 乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔.
乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔. ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.