题目内容
11.NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 标准状况下,2.24 L CHCl3的碳原子总数为0.1 NA | |
| B. | 1 mol甲醇中含有C-H键的数目为4NA | |
| C. | 1 mol-OH中电子数为10 NA | |
| D. | 常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA |
分析 A、标况下,三氯甲烷为液态;
B、甲醇的结构简式为CH3OH;
C、-OH不显电性;
D、乙烯和环丁烷的最简式均为CH2.
解答 解:A、标况下,三氯甲烷为液态,不能用气体摩尔体积来计算,故A错误;
B、甲醇的结构简式为CH3OH,故1mol甲醇中哈3molC-H键,即3NA个,故B错误;
C、-OH不显电性,即1mol羟基含9mol电子,即9NA个,故C错误;
D、乙烯和环丁烷的最简式均为CH2,故28g混合物中含有的CH2的物质的量n=$\frac{m}{M}$=$\frac{28g}{14g/mol}$=2mol,即含2mol碳原子,即2NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
1.下列物质的说法错误的是( )
| A. | 某实验过程中得到一定量的碘水,可用裂化汽油从碘水中萃取出碘 | |
| B. | 芳香烃主要来自于煤焦油和石油化工中的催化重整 | |
| C. | 常压分馏得到的汽油是混合物,没有固定的沸点 | |
| D. | 乙烯是轻质油裂解的产物,其产量可用来衡量一个国家的石油化工发展水平 |
3.国际化学年是以纪念化学学科所取得的成就以及对人类文明的贡献.下列关于生产、生活和能源中的化学知识的说法不正确的是( )
| A. | 该图表示的是“节能减排”中的节能标志 | |
| B. | 加快化石燃料的开采与使用,停止使用核能 | |
| C. | 安装煤炭“固硫”、“脱硝”装置,降低酸雨发生率 | |
| D. | 推广农作物的生物防治技术,减少农药的使用 |
20.下列关于铷(Rb)的叙述正确的是( )
| A. | 它位于周期表的第五周期,第I A族 | |
| B. | 氢氧化铷是弱碱 | |
| C. | 在钠、钾、铷3种单质中,铷的熔点最高 | |
| D. | 硝酸铷是离子化合物 |
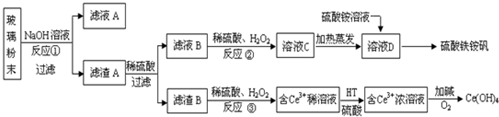


 .
.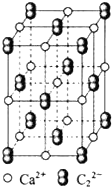 乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔.
乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔. ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.