题目内容
【题目】人体血液中存在![]() 、
、![]() 等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值Igx[x表示
等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值Igx[x表示![]() 或
或![]() 与pH的关系如图所示。已知碳酸pKa1=6.4,磷酸pKa2=7.2(pKa=-lgKa)。则下列说法正确的是
与pH的关系如图所示。已知碳酸pKa1=6.4,磷酸pKa2=7.2(pKa=-lgKa)。则下列说法正确的是

A.曲线I表示lg![]() 与pH的变化关系
与pH的变化关系
B.a→b的过程中,水的电离程度逐渐减小
C.当pH增大时,![]() 逐渐减小
逐渐减小
D.当c(H2CO3)=c(HCO3-)时,c(HPO42-)=c(H2PO4-)
【答案】C
【解析】
H2CO3HCO3-+H+的电离平衡常数Kal=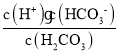 ,所以lg
,所以lg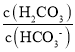 =pKal-pH=6.4-pH,H2PO4-HPO42-+H+的电离平衡常数Ka2=
=pKal-pH=6.4-pH,H2PO4-HPO42-+H+的电离平衡常数Ka2= ,所以lg
,所以lg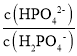 =pH-pKa2=pH-7.2,结合分析解答;
=pH-pKa2=pH-7.2,结合分析解答;
A.当lgx=0时,pH分别为6.4、7.2,所以,曲线I表示lg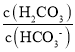 与pH的变化关系,曲线II表示lg
与pH的变化关系,曲线II表示lg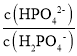 与pH的变化关系,故A错误;
与pH的变化关系,故A错误;
B.酸对水的电离有抑制作用,酸性越强即pH越小,抑制作用越大,水的电离程度越小,a→b的过程中pH增大,溶液酸性减弱,水的电离程度增大,故B错误;
C.![]() ,当pH增大时,则H2CO3HCO3+H+正向进行,使c(H2CO3)减小,而Ka1、Ka2不变,所以pH增大时,
,当pH增大时,则H2CO3HCO3+H+正向进行,使c(H2CO3)减小,而Ka1、Ka2不变,所以pH增大时,![]() 逐渐减小,故C正确
逐渐减小,故C正确
D.当c(H2CO3)=c(HCO3-)时,即lg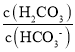 =0,溶液中pH=6.4,则lg
=0,溶液中pH=6.4,则lg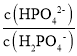 =pHpKa2=pH7.2=6.47.2=0.8<0,即c(HPO42-)<c(H2PO4-),故D错误;
=pHpKa2=pH7.2=6.47.2=0.8<0,即c(HPO42-)<c(H2PO4-),故D错误;
答案选C。

【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]____,有____个未成对电子。
(2)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因________________________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | -49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(3)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是____________。
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为____,微粒之间存在的作用力是____。
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(1/2,0,1/2);C为(1/2,1/2,0)。则D原子的坐标参数为____。
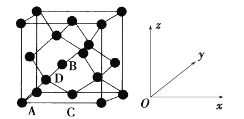
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a pm,其密度为_________g·cm-3(列出计算式即可)。
【题目】利用下图装置测定中和热的实验步骤如下:
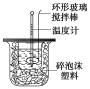
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是_________
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是__________
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌 C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒上下轻轻地抽动
(3)实验数据如下表:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
①根据表中数据计算出来温度差的平均值为______℃;
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=_______( 取小数点后一位)。
③上述实验数值结果与中和热为57.3 kJ/mol有偏差,产生偏差的原因可能是____。
a.实验装置保温、隔热效果差 b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 c.量取NaOH溶液的体积时仰视读数 d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中