题目内容
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
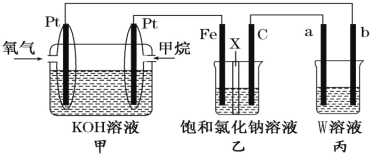
(1)石墨电极(C)作_________极,若丙池中W为Na2SO4溶液并滴有酚酞,实验开始后观察到的现象是________甲中甲烷燃料电池的负极反应式为___________________________。
(2)若消耗2.24 L(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为_________ L。
(3)若丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是__________________。
A.b电极为粗铜 B.粗铜接电源正极,发生还原反应
C.CuSO4溶液的浓度保持不变 D.利用阳极泥可回收Ag、Pt、Au等金属
(4)假设乙装置中氯化钠溶液足够多,若在标准状况下,有224 mL氧气参加反应,则乙装置中阳离子交换膜,左侧溶液质量将__________________,(填“增大”“减小”或“不变”),且变化了__________________克。
【答案】阳 两电极均有气泡冒出,左边a电极附近溶液变红 CH4+10OH--8e-=CO![]() +7H2O 4.48 AD 增大 0.88
+7H2O 4.48 AD 增大 0.88
【解析】
本题首先必须从燃料电池入手,分析出正、负极,燃料电池中投放燃料的电极是负极,投放氧化剂的电极是正极,与负极相连的为电解池的阴极,阴极发生还原反应,与正极相连的电极为阳极,阳极发生氧化反应;根据串联电池中转移电子数相等计算铁电极上生成氢气的体积;铜的精炼时,粗铜为阳极,纯铜为阴极,阳极上Cu以及活泼性比Cu强的金属失电子,阴极上铜离子得电子生成Cu;氯碱工业中的电解原理,用差量法即可求出溶液的增减。
已知在燃料电池中,投放燃料的一极是负极,所以投放甲烷的电极是负极,投放氧气等氧化剂的一极是正极,故投放氧气的是正极,与原电池正极相连的电极为阳极,故石墨电极C作为阳极,丙装置中a为阴极,b为阳极,电解硫酸钠溶液,实质上电解水,故a极发生的电极反应式为![]() ,b极发生的电极反应式为
,b极发生的电极反应式为![]() ,故现象为两电极均有气泡冒出,左边a电极附近溶液变红;燃料电池的电极反应式的书写一般为:首先写出总反应式(注意生成物与电解质溶液的反应),再写出正极反应式,最后用总反应式减去正极反应式即可得到负极反应式,KOH作电解质时,甲烷燃料电池总反应为
,故现象为两电极均有气泡冒出,左边a电极附近溶液变红;燃料电池的电极反应式的书写一般为:首先写出总反应式(注意生成物与电解质溶液的反应),再写出正极反应式,最后用总反应式减去正极反应式即可得到负极反应式,KOH作电解质时,甲烷燃料电池总反应为![]() ,正极反应式为:
,正极反应式为:![]() ,负极反应式等于总反应减去正极反应式即可,必须减去全部氧气,故负极反应式为
,负极反应式等于总反应减去正极反应式即可,必须减去全部氧气,故负极反应式为![]() ,故答案为:阳;两电极均有气泡冒出,左边a电极附近溶液变红;
,故答案为:阳;两电极均有气泡冒出,左边a电极附近溶液变红;![]() ;
;
(2)串联电池中转移电子数相等,若在标准状况下,有2.24L氧气参加反应,则转移电子的物质的量=![]() ×4=0.4mol,乙装置中铁电极上氢离子放电生成氢气,设生成氢气的体积为xL;
×4=0.4mol,乙装置中铁电极上氢离子放电生成氢气,设生成氢气的体积为xL;
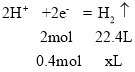 x=4.48,故答案为:4.48;
x=4.48,故答案为:4.48;
(3)A.b与正极相连为阳极,b电极为粗铜,故A正确;
B.粗铜接电源正极,作阳极,阳极上发生氧化反应,故B错误;
C.阳极上Cu以及活泼性比Cu强的金属失电子,阴极上铜离子得电子生成Cu,溶解的金属与析出的金属不相等,所以CuSO4溶液的浓度会改变改变,有所减小,故C错误;
D.Ag、Pt、Au等活泼性比Cu弱的金属在阳极不反应,形成阳极泥,所以利用阳极泥可回收Ag、Pt、Au等金属,故D正确;
故答案为:AD;
(4)乙装置中左侧为阴极区,发生的反应为:![]() ,又中间又阳离子交换膜,故Na+通过阳离子交换膜进入到左侧溶液中,故左侧溶液质量将增大;若在标准状况下,有224 mL氧气参加反应,则转移电子的物质的量=
,又中间又阳离子交换膜,故Na+通过阳离子交换膜进入到左侧溶液中,故左侧溶液质量将增大;若在标准状况下,有224 mL氧气参加反应,则转移电子的物质的量=![]() ×4=0.04mol,则进入左侧去的Na+的物质的量也为0.04mol,左侧区放出的H2为0.02mol,故左侧区溶液增重的质量为:m=0.04mol×23g/mol-0.02mol×2g/mol=0.88g,故答案为:增大 0.88。
×4=0.04mol,则进入左侧去的Na+的物质的量也为0.04mol,左侧区放出的H2为0.02mol,故左侧区溶液增重的质量为:m=0.04mol×23g/mol-0.02mol×2g/mol=0.88g,故答案为:增大 0.88。

【题目】化合物A、B是中学常见的物质,其阴阳离子可从表中选择.
阳离子 | K+、Na+、NH4+、Fe2+、Ba2+、Cu2+ |
阴离子 | OH﹣、I﹣、NO3﹣、AlO2﹣、HCO3﹣、HSO4﹣ |
(1)若A的水溶液为无色,B的水溶液呈碱性,A、B的水溶液混合后,只产生不溶于稀硝酸的白色沉淀及能使湿润的红色石蕊试纸变蓝的气体,则:
①A中的化学键类型为_________(填“离子键”、“共价键”).
②A、B溶液混合后加热呈中性,该反应的离子方程__________________________ .
(2)若A的水溶液为浅绿色,B的焰色反应呈黄色.向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合后无明显变化.则:
①A的化学式为__________________________ .
②经分析上述过程中溶液变黄的原因可能有两种(请用文字叙述)
Ⅰ._______________________.Ⅱ._________________________.
③请用一简易方法证明上述溶液变黄的原因_________________________.
④利用上述过程中溶液变黄原理,将其设计成原电池,若电子由a流向b,则b极的电极反应式为_.
【题目】马日夫盐[Mn(H2PO4)2·2H2O]在国防工业中常用作各种武器的润滑层和防护层。以软锰矿(主要成分为MnO2及少量的FeO、Al2O3和SiO2)为原料制备马日夫盐的主要工艺流程如图:
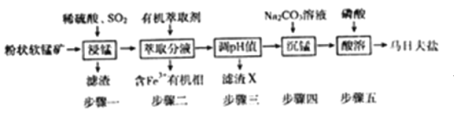
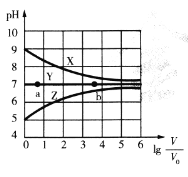
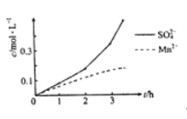
(1)“漫锰”时为了提高浸取率,可采取的措施有_________(任写出一条);在步骤一中,如果SO2气体中混有空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如图,产生该现象的原因是_______________;
(2)关于“步骤二”的说法正确的是_________ ;
A.为提高萃取率和产品产量,实验时分多次萃取并合并萃取液
B.溶液中加入萃取剂Y,转移至分液漏斗中。塞上玻璃塞,如图用力振摇

C.经几次振据并放气后,手持分液漏斗静置待液体分层
D.分液时,将分液湿斗上的玻璃塞打开或使塞上的四槽对准漏4口上的小孔,打开旋塞,待油水界面与旋塞上口相切,关闭旋塞后再从上口倒出上层液体
(3)已知几种离子开始沉淀和完全沉淀时的pH如下表所示:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
Mn2+ | 8.3 | 9.8 |
滤渣X的化学式为_____,步骤三时,pH值应调到的范围是________________;
(4)步骤四时,将Na2CO3溶液逐渐加入锰盐溶液中;若顛倒滴加顺序可能会生成__________已知Ksp(MnCO3)=2.24×10-11,加入饱和Na2CO3溶液使Mn2+恰好沉淀完全后.溶液中c(CO32-)=________;
(5)步骤五产生马日夫盐晶体的化学反应方程式为___________________。