��Ŀ����
����Ŀ��������ͼװ�òⶨ�к��ȵ�ʵ�鲽�����£�
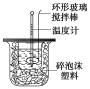
������Ͳ��ȡ50 mL 0.25 mol/L���ᵹ��С�ձ��У����������Һ�¶ȣ�
������һ��Ͳ��ȡ50 mL 0.55 mol/L NaOH��Һ����������¶ȣ�
�۽�NaOH��Һ����С�ձ��У��跨ʹ֮��Ͼ��ȣ�������Һ����¶ȡ�
�ش��������⣺
(1)����NaOH��Һ����ȷ������_________
A���ز������������� B���������������� C��һ��Ѹ�ٵ���
(2)ʹ������NaOH��Һ��Ͼ��ȵ���ȷ������__________
A�����¶ȼ�С�Ľ��� B���ҿ�ӲֽƬ�ò��������� C����������ձ� D���������¶ȼ��ϵĻ��β�������������س鶯
(3)ʵ���������±���
�¶� ʵ������� | ��ʼ�¶�t1�� | ��ֹ�¶�t2/�� | �¶Ȳ�ƽ��ֵ (t2��t1)/�� | ||
H2SO4 | NaOH | ƽ��ֵ | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
�ٸ��ݱ������ݼ�������¶Ȳ��ƽ��ֵΪ______����
�ڽ�����Ϊ0.55 mol/L NaOH��Һ��0.25 mol/L������Һ���ܶȶ���1 g/cm3���кͺ�������Һ�ı�����c��4.18 J/(g����)�����к�����H��_______( ȡС�����һλ)��
������ʵ����ֵ������к���Ϊ57.3 kJ/mol��ƫ�����ƫ���ԭ�������____��
a��ʵ��װ�ñ��¡�����Ч���� b�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶� c����ȡNaOH��Һ�����ʱ���Ӷ��� d���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
���𰸡�C D 3.4 -56.8kJ/mol abcd
��������
��ʵ���Ŀ���Dzⶨ�к��ȣ��к�����ָ��ǿ���ǿ���ϡ��Һ��ȫ��Ӧ����1molˮ�ų�����������ʵ�������Ȳⶨ��ͼӦǰ���¶ȣ�Ȼ��ⶨ��Ӧ��ֹ�¶ȣ�Ȼ�����ñ����ݽ��¶�ת��Ϊ����������к��ȡ���ʵ����Ϊ��֤��ͼ���ȫ��Ӧ��NaOH������ʵ��Ĺؼ���Ҫ���¡�
(1)Ϊ�˼���������ɢʧ��ʵ������е���NaOH��Һʱ������һ��Ѹ�ٵĵ��룬����ѡC��
(2)�¶ȼ��Dz����¶ȵģ�����ʹ���¶ȼƽ��裻Ҳ������������ձ���������ܵ���Һ�彦��������ɢʧ��Ӱ��ⶨ����������ܴ�ӲֽƬ�ò��������裬�����������ɢʧ��ʹ������NaOH��Һ��Ͼ��ȵ���ȷ���������ǣ��������¶ȼ��ϵĻ��β������������ؽ���������ѡD��
(3)���Ĵε��²�ֱ�Ϊ3.4����5.1��3.3����3.5������2������ƫ��ϴ���ȥ������ƽ���²�Ϊ![]() =3.4����
=3.4����
��50mL0.25mol/L������50mL0.55mol/LNaOH��Һ�����кͷ�Ӧ��NaOH��������������ˮ�����ʵ���Ϊ0.05L��0.25mol/L��2=0.025mol����Һ������Ϊ100ml��1g/cm3=100g���¶ȱ仯��ֵ��T=3.4����������0.025molˮ�ų�������ΪQ=mc��T=100g��4.18J/(g��)��3.4��=1421.2J����1.4212kJ������ʵ���õ��к��ȡ�H=-![]() =-56.8kJ/mol��
=-56.8kJ/mol��
��ʵ�����ľ���ֵС���к��ȵľ���ֵ��
a��ʵ��װ�ñ��¡�����Ч�������ɢʧ�ϴ������к��ȵľ���ֵƫС����a���ϣ�
b�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶ȣ��¶ȼ���մ�е�NaOH�����ᷴӦ�ų�������ʹ�òⶨ�ij�ʼ�¶�ƫ�ߣ������������ɢʧ���ⶨ���²�ƫС���к��ȵľ���ֵƫС����b���ϡ�
c����ȡNaOH��Һ�����ʱ���Ӷ������ᵼ�������������ƫ�������������������ɵ�ˮ�����ʵ������䣬�ų������������䣬�������NaOH��Һ���ƫ��ʹ���Һ������ƫ�����õ��²��ƫС���к��ȵľ���ֵƫС����c���ϣ�
d���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ��У�����ɢʧ�ϴ������к��ȵľ���ֵƫС����d���ϣ�
�ʴ�Ϊ��abcd��

����Ŀ�����и�ѡ����,����֮��ͨ��һ����Ӧ����ʵ����ͼ��ʾ�仯���ǣ� ��
ѡ�� | �� | �� | �� | �� |
A | Al | AlCl3 | Al2O3 | NaAlO2 |
B | S | H2S | SO2 | SO3 |
C | Na | Na2O | NaOH | Na2O2 |
D | N2 | NH3 | NO | NO2 |
A. AB. BC. CD. D
����Ŀ��������A��B����ѧ���������ʣ����������ӿɴӱ���ѡ��.
������ | K+��Na+��NH4+��Fe2+��Ba2+��Cu2+ |
������ | OH����I����NO3����AlO2����HCO3����HSO4�� |
��1����A��ˮ��ҺΪ��ɫ��B��ˮ��Һ�ʼ��ԣ�A��B��ˮ��Һ��Ϻ�ֻ����������ϡ����İ�ɫ��������ʹʪ��ĺ�ɫʯ����ֽ���������壬��:
��A�еĻ�ѧ������Ϊ_________���������Ӽ����������ۼ�������
��A��B��Һ��Ϻ���ȳ����ԣ��÷�Ӧ�����ӷ���__________________________ ��
��2����A��ˮ��ҺΪdz��ɫ��B����ɫ��Ӧ�ʻ�ɫ����A��ˮ��Һ�м���ϡ���������������ټ���B����Һ��ƣ���A��B��ˮ��Һ��Ϻ������Ա仯����
��A�Ļ�ѧʽΪ__________________________ ��
�ھ�����������������Һ��Ƶ�ԭ����������֣���������������
��._______________________����._________________________��
������һ������֤��������Һ��Ƶ�ԭ��_________________________��
������������������Һ���ԭ����������Ƴ�ԭ��أ���������a����b����b���ĵ缫��ӦʽΪ_��