题目内容
【题目】某学生以铁丝和Cl2为原料进行下列三个实验。下列从分类角度分析正确的是
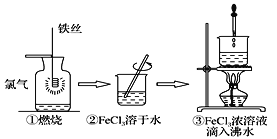
A.实验①、③反应制得的物质均为纯净物
B.③发生化学变化,最终得到的分散系为胶体
C.①反应中铁丝为还原剂,发生还原反应
D.实验①、②涉及的所有物质均为电解质
【答案】B
【解析】
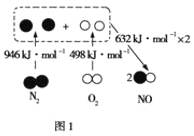
A. 实验①Fe在Cl2中燃烧产生FeCl3,得到的纯净物,③得到的是氢氧化铁胶体,是混合体系,所以不全为纯净物,A错误;
B. 将FeCl3浓溶液滴入沸水中加热煮沸,发生水解反应产生Fe(OH)3胶体和HCl,因此最终得到的分散系为胶体,B正确;
C. 实验①Fe与Cl2反应产生FeCl3中,Fe失去电子,被氧化,作还原剂,发生氧化反应,C错误;
D. 实验①中的铁和氯气是单质,既不是电解质也不是非电解质,D错误;
故合理选项是B。

练习册系列答案
相关题目