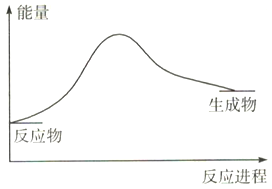
题目内容
【题目】航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,甲烷燃料电池以KOH溶液为电解质,其总反应的化学方程式为:CH4+2O2+2OH-===CO32—+3H2O。
(1)负极上的电极反应为____________________________________。
(2)消耗标准状况下的5.6 L O2时,有________ mol电子发生转移。
(3)开始放电时,正极附近溶液的pH________(填“增大”、“减小”或“不变”)。
【答案】CH4+10OH--8e-===CO32—+7H2O 1 增大
【解析】
(1)该燃料电池中,负极上燃料甲烷失电子和氢氧根离子反应生成碳酸根离子和水,正极上氧气得电子和水反应生成氢氧根离子;
(2)根据氧气和转移电子正极的关系式计算转移电子物质的量;
(3)放电时,正极附近生成氢氧根离子导致氢氧根离子浓度增大。
(1)该燃料电池中,负极上燃料甲烷失电子和氢氧根离子反应生成碳酸根离子和水,其电极反应式分别为:CH4+10OH--8e-===CO32—+7H2O,故答案为:CH4+10OH--8e-===CO32—+7H2O;
(2)氧气物质的量=![]() =0.25mol,因负极电极反应式为: 2H2O+O2+4e=4OH知,转移电子物质的量=4n(O2)=4×0.25mol=1mol,故答案为:1;
=0.25mol,因负极电极反应式为: 2H2O+O2+4e=4OH知,转移电子物质的量=4n(O2)=4×0.25mol=1mol,故答案为:1;
(3)放电时,正极附近生成氢氧根离子导致氢氧根离子浓度增大,则溶液的pH增大,故答案为:增大。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
主族 周期 | I A | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
第二周期 | ① | ② | ③ | |||||
第三周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
第四周期 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:_____(填具体元素符号,下同),原子结构示意图为_______。元素⑩名称为_________。
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子式是_________,碱性最强的化合物的电子式是:________________。
(3)用电子式表示元素④与⑥的化合物的形成过程:___________________,该化合物属于_____(填“共价”或“离子”)化合物。
(4)表示①与⑦的化合物的电子式________,该化合物是由_______(填“极性”或“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是_________(用化学式表示)。
(6)元素③的简单氢化物的结构式为_____;该氢化物常温下和元素⑦的单质反应的离子方程式为________。
【题目】研究小组进行如下表所示的原电池实验:
实验编号 | ① | ② |
实验装置 |
|
|
实验现象 | 连接好装置5分钟后,灵敏电流计指针向左偏转,两侧铜片表面均无明显现象 | 连接好装置。开始时左侧铁片表面持续产生气泡,5分钟后,灵敏电流计指针向右偏转,右侧铁片表面无明显现象 |
下列关于该实验的叙述中,正确的是
A. 两装置的盐桥中,阳离子均向右侧移动
B. 实验①中,左侧的铜被腐蚀
C. 实验②中,连接装置5分钟后,左侧电极的电极反应式为:2H++2e-=H2↑
D. 实验①和实验②中,均有O2得电子的反应发生