题目内容
【题目】一定量的Cu粉与浓H2SO4共热产生SO2气体的体积为2.24 L(标准状况下),则下列情况不可能的是( )
A.加入Cu的质量为6.4 g
B.加入的浓H2SO4中含溶质0.2 mol
C.加入Cu的质量大于6.4 g
D.加入浓H2SO4中含溶质多于0.2 mol
【答案】B
【解析】
铜粉与浓硫酸混合加热,发生反应为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,n(SO2)=2.24L÷22.4L/mol=0.1mol。随着反应的进行,硫酸的浓度会变小,稀硫酸与铜不反应,据此分析可得结论。
CuSO4+SO2↑+2H2O,n(SO2)=2.24L÷22.4L/mol=0.1mol。随着反应的进行,硫酸的浓度会变小,稀硫酸与铜不反应,据此分析可得结论。
A.由反应可知,n(Cu)=n(SO2)=0.1mol,则Cu的质量为0.1mol×64g/mol=6.4g,故A正确;
B.由反应可知,n(H2SO4)=0.2mol,随反应的进行,稀硫酸与Cu不反应,则加入浓硫酸中溶质应大于0.2mol,故B错误;
C.随反应的进行,稀硫酸与Cu不反应,加入Cu的质量可以大于6.4g,故C正确;
D.根据B知,加入浓硫酸中溶质应该大于0.2mol,故D正确;
答案选B。

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+ H2O(g)![]() CO2 (g)+ H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
CO2 (g)+ H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A. 反应在t1min内的平均速率为![]()
B. 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时n(CO2)= 0.40mol
C. 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时H2O转化率增大
D. 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
【题目】下面a~e是中学化学实验中常见的几种定量仪器:a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)无“0”刻度的是________(填字母)。
(2)下列操作合理的是________(填字母)。
A.用25 mL碱式滴定管量取20.00 mL NaHCO3溶液
B.用托盘天平准确称量10.20 g碳酸钠固体
C.用100 mL量筒量取3.2 mL浓硫酸
D.用500 mL容量瓶配制1 mol·L-1的氢氧化钠溶液495.5 mL
(3)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,若滴定开始和结束时,酸式滴定管中的液面如图所示:则所用盐酸的体积为________mL。
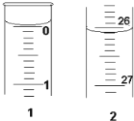
(4)某学生根据三次实验分别记录有关数据如下表:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积 | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理数据列出该氢氧化钠溶液物质的量浓度(计算结果保留4位有效数字):c(NaOH)=________ mol·L-1。
(5)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是________(填字母)。
A.中和滴定达终点时俯视滴定管内液面读数
B.碱式滴定管用蒸馏水洗净后立即取用25.00 mL待测碱溶液注入锥形瓶进行滴定
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定
【题目】某兴趣小组用镀锌铁皮按下列流程制备七水合硫酸锌(ZnSO4·7H2O)

相关信息如下:①金属离子形成氢氧化物沉淀的相关pH范围。②ZnSO4的溶解度(物质在100g水中溶解的质量)随温度变化曲线。

金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Zn2+ | 5.4 | 8.2 |
请回答:
(1)①镀锌铁皮上的油污可用Na2CO3溶液去除,理由是_______________________________。②步骤Ⅰ,可用于判断镀锌层完全反应的实验现象是__________________________。
(2)步骤Ⅱ,需加入过量H2O2,理由是____(请简述理由,并且写出对应的离子反应方程式)。
(3)步骤Ⅲ,合适的pH范围是____________________。
(4)步骤Ⅳ,需要用到下列所有操作:a.蒸发至溶液出现晶膜;b.在60℃蒸发溶剂;c.冷却至室温;d.在100℃蒸发溶剂;e.过滤。请给出上述操作的正确顺序_____________(操作可重复使用)。
(5)步骤Ⅴ,某同学采用不同降温方式进行冷却结晶,测得ZnSO4·7H2O晶体颗粒大小分布如图所示。根据该实验结果,为了得到颗粒大小相对均一的较大晶粒,宜选择_______方式进行冷却结晶。

A. 快速降温 B. 缓慢降温 C. 变速降温






