题目内容
【题目】据报道,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将给量子计算机的研究带来重大突破。已知铷是37号元素。根据相关知识回答下列问题:
(1)铷(Rb)位于元素周期表的第________周期________族。
(2)关于铷的结构和性质判断正确的是________(填序号)。
①与水反应比钠剧烈
②它的原子半径比钠小
③它的氧化物暴露在空气中易吸收CO2
④它的阳离子最外层电子数和镁相同
⑤它是还原剂
(3)现有铷和另一种碱金属形成的合金50 g,当它与足量水反应时,放出标准状况下的氢气22.4 L,这种碱金属可能是________(填序号)。
a.Li b.Na
c.K d.Cs
【答案】五 ⅠA ①③⑤ ab
【解析】
(1)由Rb的原子序数是37可推知。
(2)根据Rb的原子结构示意图,Na和Rb同主族,根据同主族元素性质的递变规律的结论。
(3)设该合金的平均相对原子质量为M,则根据得失电子守恒定律等式,得出平均摩尔质量,再根据平均值的关系得到结论。
(1)由Rb的原子序数是37可推知Rb位于第五周期ⅠA族;故答案为:五;ⅠA。
(2)由Rb的原子结构示意图可知②④不正确;又因Na和Rb同主族,根据同主族元素性质的递变规律知,Rb的金属性比Na强,故①③⑤正确;故答案为:①③⑤。
(3)设该合金的平均相对原子质量为M,则根据得失电子守恒定律得![]() ,解得M=25,因Mr(Rb)>25,则另一种碱金属的相对原子质量应小于25,可能为Li或Na;故答案为:ab。
,解得M=25,因Mr(Rb)>25,则另一种碱金属的相对原子质量应小于25,可能为Li或Na;故答案为:ab。

 名校课堂系列答案
名校课堂系列答案【题目】过氧化碳酰胺[CO(NH2)2H2O2]是一种高效、安全的固体消毒剂,白色晶体,易溶于水,稍高温度时可发生分解。某化学小组欲制备少量过氧化碳酰胺,并测定其活性氧的含量,回答下列问题。
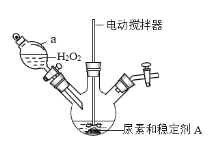
(一)过氧化碳酰胺的制备
(1)制备过氧化碳酰胺的发生装置如图所示(夹持装置略去),在组装仪器前应对a装置进行的操作是________。
(2)该反应的最佳温度为35℃,采用的合适加热方式为________。
(二)过氧化碳酰胺中活性氧含量的测定(以产品中过氧化氢所含氧原子的质量分数为准计算)。称取10.0g产品,配成250mL溶液,取25.00mL溶液于锥形瓶中,加入适量稀硫酸,用0.10molL-1高锰酸钾标准溶液滴定三次,消耗高锰酸钾溶液的体积分别为21.02mL、21.23mL、20.98mL。
(1)写出KMnO4标准溶液与H2O2反应的化学方程式____________。
(2)过氧化碳酰胺中活性氧含量为_____%。若配制过氧化碳酰胺溶液定容时俯视刻度线,则测得过氧化碳酰胺中活性氧含量______(填“偏高”“偏低”或“无影响”)。
(三)稳定剂A对过氧化碳酰胺的制备有一定的影响,小组成员查阅文献资料得到有关稳定剂及数据如表所示。则选择最佳稳定剂A为________,理由是_____________。
稳定剂名称 | 过氧化碳酰胺活性氧的含量/10-2 | ||||
初始数 | 室温储存30天后数 | 减少量 | 热储存保温1天后数 | 减少量 | |
EDTA | 16.96 | 16.87 | 0.09 | 16.92 | 0.04 |
柠檬酸 | 16.94 | 16.90 | 0.04 | 16.91 | 0.03 |
EDTA与柠檬酸混合物 | 16.95 | 16.90 | 0.05 | 16.90 | 0.05 |
柠檬酸与焦磷酸钠混合物 | 16.90 | 16.86 | 0.04 | 16.87 | 0.03 |