题目内容
【题目】碳和碳的化合物在生产、生活中的应用非常广泛。 现将不同量的CO2(g)和H2(g)分别通入体积为2L的恒容密闭容器中,进行如下反应:CO2(g)+H2(g)![]() [Failed to download image : ]CO(g)+H2O(g),得到如下三组数据:
[Failed to download image : ]CO(g)+H2O(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
CO2 | H2 | CO | |||
1 | 800 | 4 | 2.5 | 1.5 | 5 |
2 | 830 | 2 | 2 | 1 | 3 |
3 | 830 | 2 | 2 | 1 | 1 |

(1)实验1中,平衡常数K=0.9;v(H2)=0.15mol/(Lmin)该反应的正反应为______(填“吸”或“放”)热反应;
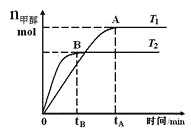
(2)实验3跟实验2相比,改变的条件可能是___________________________
(答一种情况即可);若该反应符合图所示的关系,则在图中Y轴表示___________________________
(3)能判断该反应达到化学平衡状态的依据是______(多选扣分).
a.容器中压强不变 b.混合气体中c(CO )不变
c.v(H2)正=v(H2O)逆 d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(H2)=c(CO)c(H2O)由此可以判断此时的温度为______.其它条件不变,升高温度,原化学平衡向______反应方向移动(填“正”或“逆”),容器内混合气体的密度______(填“增大”、“减小”或“不变”).
(5)
【答案】 吸热 使用了催化剂或加大了压强 CO2或H2的百分含量(或其浓度,质量,物质的量) b,c 830 正 不变 33.3%
【解析】(1)从表格数据分析,温度升高,二氧化碳的转化率从原来的1.5/4变为1/2,转化率增大,说明平衡正向移动,则正反应为吸热反应。(2)实验3和实2比,起始加入量相同,温度相同,但是到平衡的时间缩短,说明实验3使用了催化剂或加大了压强;随着温度升高,平衡正向移动,则Y的数值变小,说明Y可以是CO2或H2的百分含量(或其浓度、质量、物质的量等)。(3)a、容器中的压强始终不变,a错误;b、混合气体中一氧化碳的浓度不变,可以说明达到平衡,b正确;c、正逆反应速率相等,说明达到平衡,c正确;d、一氧化碳的浓度和二氧化碳的浓度相等不能说明反应达到平衡,d错误。故选bc。(4)根据平衡常数的表达式分析,此时平衡常数为1,结合表中的数据分析,该温度为830℃。升温,平衡正向移动,但混合气体的总质量不变,总体积不变,所以密度不变。(5)根据方程式可知
CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
起始量(mol) 0 0 0.4 0.2
改变量(mol) x x x x
平衡量(mol) x x 0.4-x 0.2-x
则有(0.4-x)(0.2-x)/x×x=1,解得x=0.8/6,则一氧化碳的转化率=![]() ×100%=33.3%。
×100%=33.3%。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案