��Ŀ����
����Ŀ���������[Ca(NO2)2]��ˮ���������Ӽ�����Ҫԭ�ϡ�ij��ȤС�����Ʊ�Ca(NO2)2���������ʽ���̽�����ش������й����⡣
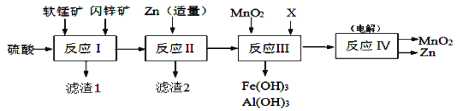
�������زģ���NO+CaO2��Ca(NO2)2��2NO2+CaO2��Ca(NO3)2��
II�����������һ���������Ժͻ�ԭ�ԣ����������£�Ca(NO2)2�ܽ�I-����ΪI2��
��I2��2S2O32��=2I����S4O62��
���Ʊ�Ca(NO2)2����С����Ƶ��Ʊ�װ����ͼ��ʾ���г�װ����ȥ����
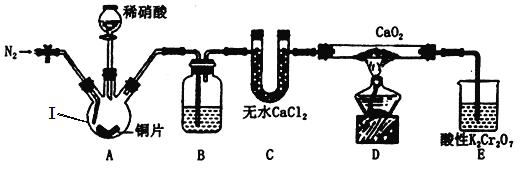
��1���������������___________________��B��ʢװ���Լ���____________________��
��2���Ʊ������йز������£���ȷ˳��Ϊ_______��c��_______��_______��_______��_______��
a����װ����ͨ��N2 b�����������еμ�ϡ���� c����ȼ�ƾ��� d��Ϩ��ƾ��� e��ֹͣͨ��N2 f���رշ�Һ©������
��3��װ��E�У�����K2Cr2O7��Һ�ɽ�ʣ���NO������NO3������Һ�ɳ�ɫ��Ϊ��ɫ��Cr3+����������Ӧ�����ӷ���ʽΪ__________________________��
��4���������̳���ͨN2��������______________��_____________��____________��
���ⶨCa(NO2)2�Ĵ��ȣ���С��ⶨ��Ʒ��Ca(NO2)2���ȵķ������£�a����ȡmg��Ʒ���ܽ⡢������250mL��b����ȡ25.00mL��Һ����ƿ�У����������V1 mLc1mol/L��KI��Һ���ữ��c���Ե���Ϊָʾ������c2mol/L��Na2S2O3��Һ�ζ�����������ƽ��ʵ�飬���ı�Һ���ƽ��ֵΪV2 mL��
��5���ⶨ��������������ʹ��ǰ�������Ƿ�©Һ����______________________��
��6���ò�Ʒ��Ca(NO2)2����������Ϊ_____________________��
���𰸡�������ƿˮ�����������ƣ�a bfde2NO + Cr2O72- + 6H+�T 2NO![]() + 2Cr3+ + 3H2O����װ���еĿ����������ɵ�NOʹ֮����D��ֹ����250mL����ƿ���ζ���
+ 2Cr3+ + 3H2O����װ���еĿ����������ɵ�NOʹ֮����D��ֹ����250mL����ƿ���ζ���![]()
��������
��װ����ͨ��N2������װ���е���������ȼ�ƾ��ƣ���������ƿ�еμ�ϡ���ᣬͭ��ϡ���ᷴӦ����һ���������壬ͨ��װ��B�dz�ȥ�����е�����������ͨ��װ��C(��ˮ�Ȼ���)���������װ��D�й������Ʒ�Ӧ����Ca(NO2)2�����ͨ�������ظ���ؽ�ʣ���NO������NO3-����Һ�ɳ�ɫ��Ϊ��ɫ(Cr3+)��ֹͣͨ�뵪����
(1)����ͼʾ��������Ϊ������ƿ���ɷ�����֪B�dz�ȥһ�������л��е�����������B��ʢ�ŵ��Լ�������ˮ���������ƣ������dz�ȥHNO3���ʴ�Ϊ��������ƿ������ˮ���������ƣ�
(2)��װ����ͨ��N2������װ���е���������ȼ�ƾ��ƣ���������ƿ�еμ�ϡ���ᣬͭ��ϡ���ᷴӦ����һ���������壬ͨ��װ��B(����������Һ)��ȥ�����е��������壬ͨ��װ��C(��ˮ�Ȼ���)��������������װ��D�й������Ʒ�Ӧ����Ca(NO2)2�����ͨ�������ظ���ؿɽ�ʣ���NO��������������ȷ����Ϊ��a c b f d e���ʴ�Ϊ��a��b��f��d��e��
(3)��Ӧ��Cr2O72-����ԭ��Cr3+��NO��������NO3-�����ӷ�Ӧ����ʽΪ��2NO+Cr2O72-+6H+=2Cr3++NO3-+3H2O���ʴ�Ϊ��2NO+Cr2O72-+6H+=2Cr3++NO3-+3H2O��
(4)װ���к��п���������������������һ������������ͨ�뵪����Ŀ�����ų�װ������������ֹ�佫���ɵ�һ�������������ɶ��������������Ǵ���װ���е�NOʹ֮����D�з�Ӧ�������ֹ���������ã��ʴ�Ϊ������װ���е�����������װ���е�NOʹ֮����D����ֹ������
(5)��������ԭ�ζ����ⶨ�����У�����������ʹ��ǰ�������Ƿ�©Һ����250mL����ƿ���ζ��ܣ��ʴ�Ϊ��250mL����ƿ���ζ��ܣ�
(6)�����������£�Ca(NO3)2�ܽ�I-����ΪI2��S2O32-�ܽ�I2��ԭΪI-��֪������2NO2-��I2��2S2O32-������Na2S2O3�����ʵ���Ϊc2molL-1��V2��10-3L=0.001c2V2mol����Ca(NO2)2�����ʵ���Ϊ0.001c2V2mol��![]() ����Ca(NO2)2����������Ϊ
����Ca(NO2)2����������Ϊ![]() ��100%=
��100%=![]() %���ʴ�Ϊ��
%���ʴ�Ϊ��![]() %��
%��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��̼��̼�Ļ������������������е�Ӧ�÷dz��㷺�� �ֽ���ͬ����CO2��g����H2��g���ֱ�ͨ�����Ϊ2L�ĺ����ܱ������У��������·�Ӧ��CO2(g��+H2��g��![]() [Failed to download image : ]CO��g��+H2O��g�����õ������������ݣ�
[Failed to download image : ]CO��g��+H2O��g�����õ������������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | |
CO2 | H2 | CO | |||
1 | 800 | 4 | 2.5 | 1.5 | 5 |
2 | 830 | 2 | 2 | 1 | 3 |
3 | 830 | 2 | 2 | 1 | 1 |

��1��ʵ��1�У�ƽ�ⳣ��K=0.9��v��H2��=0.15mol/��Lmin���÷�Ӧ������ӦΪ______��������š����ȷ�Ӧ��
��2��ʵ��3��ʵ��2��ȣ��ı������������___________________________
����һ��������ɣ������÷�Ӧ����ͼ��ʾ�Ĺ�ϵ������ͼ��Y���ʾ___________________________
��3�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������______����ѡ�۷֣���
a��������ѹǿ���� b�����������c��CO ������
c��v��H2����=v��H2O���� d��c��CO2��=c��CO��
��4��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO2��c��H2��=c��CO��c��H2O���ɴ˿����жϴ�ʱ���¶�Ϊ______�������������䣬�����¶ȣ�ԭ��ѧƽ����______��Ӧ�����ƶ�����������桱���������ڻ��������ܶ�______�����������С�����䡱����
��5��