��Ŀ����
����Ŀ��2017��3��21���ǵڶ�ʮ��조����ˮ�ա�������ˮ��Դ���������÷�ˮ��ʡˮ��Դ����ǿ��ˮ�Ļ��������ѱ�Խ��Խ���������ע����֪��ij��ɫ��ˮ�п��ܺ���H����NH4+��Fe3����Al3����Mg2����Na����NO3����CO32����SO42���еļ��֣�Ϊ������ɷ֣��ֱ�ȡ��ˮ��Ʒ100mL������������ʵ�飬��������й�ͼ��������ʾ��

��ش��������⣺
��1����������3��ʵ����Է�����ˮ��һ�������ڵ���������_________________��һ�����ڵ���������__________________________��
��2��д��ʵ���ͼ���г�����ʼ��������ȫ��ʧ�η�����Ӧ�����ӷ�Ӧ����ʽ��__________________��
��3������ͼ����ԭ��Һ��c(NH4+)��c(Al3��)�ı�ֵΪ______________________�����ó��������������_____________________g��
��4����ͨ��ʵ��ȷ��ԭ��ˮ��c(Na��)=0.14 mol��L1,���ж�ԭ��ˮ��NO3�Ƿ���ڣ�_______������ڡ��������ڡ���ȷ�������� �����ڣ�c(NO3)=___________mol��L1�����������ڻ�ȷ����˿ղ��
���𰸡�CO32- Na+��H+��Al3+��NH4+ Al(OH)3 + OH�� = AlO2-+2H2O 1:1 0.546 g ���� 0.36 mol��L-1
��������
��ɫ��Һ�ų������ӣ���ɫ��Ӧ�Ի�ɫ��˵�����������ӣ����������ữ���Ȼ�����Һ������ɫ������˵������SO42������μ�������������Һ����ʼ��û�г�����˵�����������ӣ���һ��������CO32���������ﵽ���ֵ���������������ƣ������������ܽ⣬˵���ýη���笠����������ķ�Ӧ����һ������NH4+����������ȫ��ʧ��˵������ֻ���������������һ������Al3+��û��Mg2��������й����ݸ��ݵ���غ�����жϡ�
��1����ɫ��ˮ��һ��������Fe3+������ʵ���ȷ������Na+������ʵ���ȷ������SO42��������ʵ���ȷ����H+��Al3+��NH4+��û��CO32����Mg2+����˷�ˮ��һ�������ڵ���������CO32����һ�����ڵ���������Na+��H+��Al3+��NH4+��
��2��ʵ���ͼ���г�����ʼ��������ȫ��ʧ�η����ķ�Ӧ�����������ܽ�������������Һ�У���Ӧ�����ӷ�Ӧ����ʽΪAl(OH)3+OH����AlO2-+2H2O��
����ͼ���֪��笠���Ӧ�������������ʵ�����0.042mol��0.035mol��0.007mol�����ݷ�ӦNH4++OH-��NH3H2O��֪笠������ʵ�����0.007mol�����������������������Ƶ����ʵ�����0.035mol��0.014mol��0.021mol�����ݷ���ʽAl3++3OH����Al(OH)3����֪�����ӵ����ʵ�����0.021mol��3��0.007mol��������ԭ��Һ��c(NH4+)��c(Al3��)�ı�ֵΪ1:1�����ó��������������0.007mol��78g/mol��0.546g��
��4������ͼ���֪�к���������������������0.014mol���������ӵ����ʵ�����0.014mol�����ᱵ������������2.33g��n��SO42-����2.33g��233g/mol��0.01mol�����ݵ���غ㣬�����ӵ�������ʵ���Ϊ0.01mol��2��0.02mol�������ӵ�������ʵ���Ϊn��H+��+n��Al3+��+n��NH4+��+n��Na+����0.014mol+0.007��3mol+0.007mol+0.14mol/L��0.1L��0.056mol����ԭ��ˮ�д���NO3-�����ʵ�����0.056mol��0.02mol��0.036mol����c��NO3-����0.036mol��0.1L��0.36mol/L��

����Ŀ��X��Y��Z��M��W��Q��R��7�ֶ�����Ԫ�أ���ԭ�Ӱ뾶����Ҫ���ϼ����£�
Ԫ�ش��� | X | Y | Z | M | W | Q | R |
ԭ�Ӱ뾶/nm | 0.186 | 0.143 | 0.104 | 0.099 | 0.070 | 0.066 | 0.032 |
��Ҫ���ϼ� | +1 | +3 | +6����2 | +7����1 | +5����3 | ��2 | +1 |
���������գ�
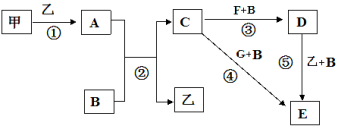
��1������Ԫ���У���������ǿ�������ڱ��е�λ����________________________________��X��Y��Q�����γɵļ������������Ӱ뾶�ɴ�С��˳����_______(�����ӷ���)��
W��R��ԭ�Ӹ�����1�s4���ɵ������������Ļ�ѧ����____________________��
��2����������4�ֵ�������Ԫ�ص�����������ˮ���������������_______(�ѧ
ʽ)������뷽��ʽΪ_____________________________________��
��3��M��Z��ȣ��ǽ����Խ�ǿ����_____________����Ԫ�����ƣ������ԭ�ӽṹ�ĽǶ�˵������_________________________________________________________________��
��4����ϡ�����У�KMnO4��H2O2�ܷ���������ԭ��Ӧ����Ӧ����ʽ���£�
![]() KMnO4��
KMnO4��![]() H2O2+
H2O2+![]() H2SO4 ��
H2SO4 �� ![]() K2SO4��
K2SO4��![]() MnSO4��
MnSO4��![]() O2����
O2����![]() H2O
H2O
����ƽ������0.5 mol H2O2�μӴ˷�Ӧ������ת�Ƶĸ���Ϊ______________________��
����Ŀ��̼��̼�Ļ������������������е�Ӧ�÷dz��㷺�� �ֽ���ͬ����CO2��g����H2��g���ֱ�ͨ�����Ϊ2L�ĺ����ܱ������У��������·�Ӧ��CO2(g��+H2��g��![]() [Failed to download image : ]CO��g��+H2O��g�����õ������������ݣ�
[Failed to download image : ]CO��g��+H2O��g�����õ������������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | |
CO2 | H2 | CO | |||
1 | 800 | 4 | 2.5 | 1.5 | 5 |
2 | 830 | 2 | 2 | 1 | 3 |
3 | 830 | 2 | 2 | 1 | 1 |
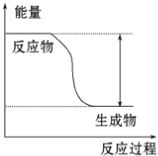
��1��ʵ��1�У�ƽ�ⳣ��K=0.9��v��H2��=0.15mol/��Lmin���÷�Ӧ������ӦΪ______��������š����ȷ�Ӧ��
��2��ʵ��3��ʵ��2��ȣ��ı������������___________________________
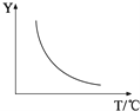
����һ��������ɣ������÷�Ӧ����ͼ��ʾ�Ĺ�ϵ������ͼ��Y���ʾ___________________________
��3�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������______����ѡ�۷֣���
a��������ѹǿ���� b�����������c��CO ������
c��v��H2����=v��H2O���� d��c��CO2��=c��CO��
��4��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO2��c��H2��=c��CO��c��H2O���ɴ˿����жϴ�ʱ���¶�Ϊ______�������������䣬�����¶ȣ�ԭ��ѧƽ����______��Ӧ�����ƶ�����������桱���������ڻ��������ܶ�______�����������С�����䡱����
��5��