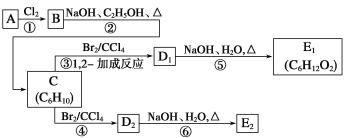
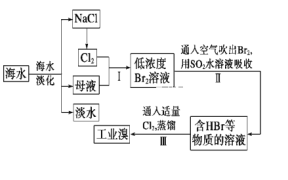
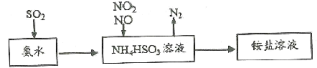
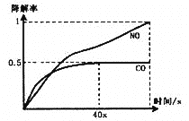
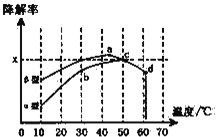
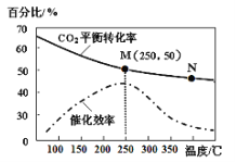
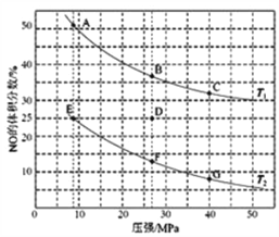
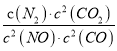题目内容
【题目】某固体粉末甲中可能含有K2CO3、KNO3、NaNO2、K2SO3、Na2SO4、Fe、FeO、Fe2O3中的若干种。某同学为确定该固体粉末的成分,取甲进行连续实验。实验过程及现象如下:
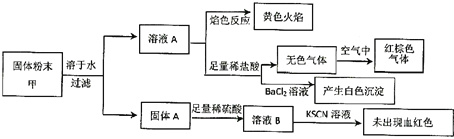
该同学得出的结论正确的是( )
A.固体粉末中含有钠元素,但不含钾元素
B.固体粉末中至少含有Na2SO4、K2SO3中的一种
C.固体粉末中至少含有KNO3、NaNO2中的一种
D.固体粉末中可能含有K2CO3、不含Fe2O3
【答案】C
【解析】
A、焰色反应呈黄色,说明含有钠元素,则至少含有NaNO2、Na2SO4中的一种,因未透过蓝色钴玻璃,不能确定是否含有钾元素,A错误;
B、若固体粉末含有K2SO3,无Na2SO4,则可能存在KNO3、NaNO2:2H++2NO3-+3SO32-=3SO42-+2NO↑+H2O,2H++2NO2-+SO32-=SO42-+2NO↑+H2O,对应的现象都是先产生无色气体,接触空气后才变为红棕色;若固体粉末无K2SO3,含有Na2SO4,溶液中无还原性物质,KNO3是不会反应生成NO的,而KNO2遇到酸发生分解生成NO和NO2,气体不需要接触空气就呈红棕色,不符合实验现象,故固体粉末中一定有K2SO3,无法推出Na2SO4的存在情况,B错误;
C、由B选项的分析可知,固体粉末中至少含有KNO3、NaNO2中的一种,C正确;
D、根据实验现象,不能推出K2CO3的存在情况;若固体粉末中含有Fe、Fe2O3,且Fe的量较多,则会发生反应:Fe+2Fe3+=3Fe2+,再加入KSCN溶液,溶液不会出现血红色,则不能说明不含Fe2O3,D错误;
故选C。

【题目】钛是一种活泼金属。从高钛渣(主要为TiO2)提炼海绵钛流程如下:
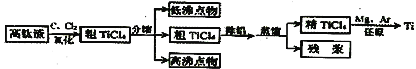
氯化后的粗TiCl4中含有FeCl3、SiCl4、AlCl3等杂质,相关物质的沸点如下表:
化合物 | TiCl4 | FeCl3 | SiCl4 | AlCl3 |
沸点/℃ | 136 | 310 | 56.5 | 180 |
下列说法不正确的是( )
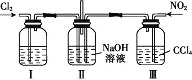
A.“氯化”反应的尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是H2O、FeCl2溶液、NaOH溶液
B.“分馏”得到的低沸点物为SiCl4,高沸点物为FeCl3
C.己知“除铝”的方法是用水湿润的活性炭加入到粗TiCl4,目的是将AlCl3转化为Al(OH)3而除去
D.“还原”过程中还原剂可以选择金属钠,气氛可以选择N2