题目内容
下列各组性质比较中,正确的是
①酸性:HClO4>HBrO4>HIO4 ②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2
③非金属性:F>C>O ④氧化性:Li+﹤Na+﹤K+
⑤气态氢化物沸点:HF>HCl
| A.①②③ | B.②③④ | C.①②⑤ | D.①②④⑤ |
C
解析试题分析:同主族自上而下,金属性逐渐增强,非金属性逐渐减弱。非金属性越强,最高价氧化物的水化物的酸性越强。金属性越强,最高价氧化物的水化物的碱性越强,则选项①、②正确;同周期自左向右非金属性逐渐增强,所以非金属性:F >O>C,③不正确;金属性越强,相应阳离子的氧化性越弱,选项④不正确,氧化性:Li+>Na+>K+;非金属性越强,氢化物的稳定性越强,⑤正确,答案选C。
考点:考查元素周期律的应用
点评:该题主要是考查学生对元素周期律的熟悉了解程度,以及灵活运用元素周期律解决实际问题的能力。难度不大。该题的关键是熟练记住元素周期律的具体内容,然后结合题意灵活运用即可,有利于培养学生的逻辑思维能力。

练习册系列答案
相关题目
下图是短周期元素原子半径与最外层电子数的关系图,其中乙单质是半导体,下列说法正确的是( )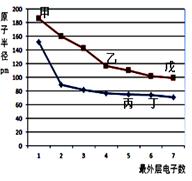
| A.丙的氢化物与丙的最高价氧化物的水化物能发生化合反应 |
| B.气态氢化物的稳定性:丙>丁>戊 |
| C.甲的离子半径比丁的简单离子半径小 |
| D.乙与丁形成的化合物含共价键,同时是两性氧化物 |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5 、+3、 -3 | -2 |
下列-叙述正确的是
A.X、Y元素的金属性X<Y
B.Z的气态氢化物比W的气态氢化物稳定
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.X能在Z 的单质中燃烧
短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列推断正确的是( )
| A.原子半径:W>X>Z>Y | B.热稳定性:H2Y>HZ |
| C.离子半径:W2+>Y2- | D.碱性:XOH>W(OH)2 |
下列说法正确的是( )
| A.周期表中的主族都有非金属元素 | B.周期表中的主族都有金属元素 |
| C.周期表中的非金属元素都位于短周期 | D.周期表中的过渡元素都是金属元素 |
下列提出原子学说的科学家是( )
| A.拉瓦锡 | B.道尔顿 | C.门捷列夫 | D.波义耳 |
关于同位素,下列说法中正确的是
| A.质子数相同,质量数不同,化学性质几乎相同 |
| B.质子数不同,质量数相同,化学性质相同 |
| C.质子数相同,中子数相同,化学性质几乎相同 |
| D.质子数相同,质量数不同,化学性质不同 |
下列各组粒子所含电子数目相同的是
| A.NH4+、OH-、H3O+ |
| B.Na+、Mg2+、S2- |
| C.F-、NH2-、Cl- |
| D.Li+、Na+、K+ |