题目内容
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N元素的电负性由大到小的顺序是 ,
C60和金刚石都是碳的同素异形体,二者相比,熔点高的是 ,原因是 。
(2)A、B均为短周期金属元素,依据表中数据,写出B的基态原子的电子排布式: 。
| 电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
[Mn(H2O)6]2+ (填“无”或“有”)颜色。
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为
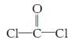 ,每个COCl2分子内含有 个σ键, 个π键,其中心原子采取 杂化轨道方式。
,每个COCl2分子内含有 个σ键, 个π键,其中心原子采取 杂化轨道方式。②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)。反应过程中,断裂的化学键只有配位键,则形成的化学键类型是 。
(12分)(1)N>C>Si(2分) 金刚石(1分) 金刚石为原子晶体,C60为分子晶体(1分)
(2)1s22s22p63s2(2分)
(3)有(2分)
(4)①3 1 sp2 ②金属键(各1分)
解析试题分析:(1)根据电负性的变化规律,同周期元素从左到右逐渐增大,同主族从上到下逐渐减小,所以C、Si、N元素的电负性由大到小的顺序是N>C>Si;C60和金刚石相比,熔点高的是金刚石,因为金刚石是原子晶体,C60为分子晶体,原子晶体的熔点都比分子晶体的熔点高;
(2)由表中数据可知,A、B都是第二主族元素,因为第一、第二电离能接近,与第三电离能差距较大;B的第一电离能小于A,说明B在A的下方,所以短周期元素中B是Mg;所以核外电子排布式为1s22s22p63s2;
(3)[Mn(H2O)6]2+中的Mn2+的外围电子排布为3d5,所以[Mn(H2O)6]2+有颜色;
(4)①根据单键都是σ键,双键中有1个σ键和1个π键,根据COCl2分子结构判断该分子中含有3个σ键,和1个π键,C原子周围有3个σ键,所以是sp2杂化;
②铁单质中存在金属键,CO分子保持不变,所以形成的化学键类型是金属键。
考点:考查电负性的比较,晶体类型的判断,元素的推断,核外电子排布式的书写,化学键类型的判断

 智慧小复习系列答案
智慧小复习系列答案已知A、B、C、D、E、F、G位于元素周期表的前四周期,且元素原子序数依次增加,A焰色反应呈黄色;工业常用电解B的熔融的氯化物来制备B,C是一种能被HF和NaOH溶液溶解的单质,D的电负性比磷大,第一电离能却比磷小,E单质是制备漂白液的原料,F能形成红色(或砖红色)和黑色的两种氧化物,G是一种主族金属。
(1)前四周期所有元素中,基态原子中未成对电子与其所在周期数相同的元素有 种。
(2)元素A、B、C分别与氟气化合形成物质X、Y、Z熔点见下表:
| 氟化物 | X | Y | Z |
| 熔点/K | 1266 | 1534 | 183 |
(3)已知常温条件下,极性分子DOE2是一种液态化合物,中心原子D的杂化方式是 。向盛有10mL水的锥形瓶中滴加少量的DOE2溶液,生成两种有刺激性气味的气体。请书写此反应的化学方程式 。
(4)G与氮原子可1:1化合,形成人工合成的新型半导体材料,其晶体结构与单晶硅相似。G原子的价电子排布式为 。在该合成材料中,与同一个G原子相连的N原子构成的空间构型为正四面体。在四种基本晶体类型中,此晶体属于 晶体。
(5)F晶体的堆积方式是 (填堆积名称),其配位数为 。 向F的硫酸盐溶液中滴加氨水直至过量,写出此过程所涉及的两个离子方程式 根据价层电子对互斥理论,预测SO42-的空间构型为 。
 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体