题目内容
现有四种短周期元素X、Y、Z、W,它们的原子序数依次增大。其中:①X原子是元素周期表中原子半径最小的;②Y的L层电子是K层电子的2倍;③Z的最外层电子是内层电子的3倍;④W与X同主族。请回答下列问题:
(1)X的元素符号为 ,Y在周期表中的位置是 ,
Z单质的化学式为 。
(2)X与Z组成的含有非极性共价键的化合物的分子式为 ;化合物W2Z2的电子式为 。
(3)向Na2SiO3的溶液中缓慢通入过量的YZ2,反应的离子方程式是 ;分子中有10个电子,则X与Z组成的分子为 、X与Y组成的分子式为_______。
(1)(4分)H(1分) 第二周期(1分)、第ⅣA族(1分) O2(1分)
(2)(2分)H2O2 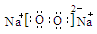
(3)(4分)2 CO2 + 2 H2O + SiO32— ==2 HCO3—+ H2SiO3↓(2分) H2O(1分) CH4(1分)
解析试题分析:由X原子是元素周期表中原子半径最小的可知X为氢,由Y的L层电子是K层电子的2倍可知Y为碳,由Z的最外层电子是内层电子的3倍,可知Z为氧,W与X同主族且四种短周期元素X、Y、Z、W,它们的原子序数依次增大,可知W为钠。
考点:考查元素周期表的相关知识点。

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
下列说法正确的是( )
| A.周期表中的主族都有非金属元素 | B.周期表中的主族都有金属元素 |
| C.周期表中的非金属元素都位于短周期 | D.周期表中的过渡元素都是金属元素 |
某元素原子价电子构型3d54S2,其应在周期表( )
| A.第四周期ⅡA族 | B.第四周期ⅡB族 |
| C.第四周期ⅦA族 | D.第四周期ⅦB族 |
价电子总数与原子总数都相同的分子、离子或原子团称为等电子体,等电子体具有相似的结构和性质。下列选项中互称为等电子体的是
A.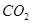 和 和 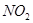 | B.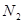 和 和  |
C.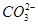 和 和 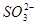 | D. 和 和 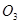 |
(10分)下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
 族 族周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | | | | ① | ② | ③ | ④ | |
| 三 | ⑤ | ⑥ | ⑦ | | | ⑧ | ⑨ | ⑩ |
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(3)⑤⑥⑦单质的活泼性顺序为_____>_____>____ (填元素符号),判断的实验依据是_______(写出一种)。