题目内容
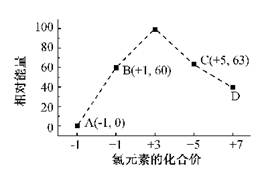
(12分)A、B、C、D 四种主族元素原子序数均在20以内,A元素所处的周期数、主族序数、原子序数均相等,B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3 ,C元素原子的最高正价为+6价,C的阴离子与D的阳离子具有相同的电子排布,D可与C形成化合物D2C。
(1)D元素的名称_______;B在周期表中的位置:第_______周期第_______族
(2)A、B形成的化合物以_______共价键相结合(填极性或非极性)
(3)以C的最高价氧化物对应的水化物作为电解质溶液,组成氢氧燃料电池,放电时则负极区溶液的pH_______(填增大、减小、不变)
(4)以D的最高价氧化物对应的水化物作为电解质溶液,组成氢氧燃料电池,则正极的电极反应式为_____________________
(5)A、B、C、D四种元素简单离子的离子半径由大到小的顺序是(用离子符号表示) ____________________________
(6)C的质子数和中子数相等,则C 的原子组成符号为_______它形成的氢化物的还原性_______氯化氢(填强于或弱于)
(1)钾 二 ⅤA (各1分,共3分)
(2)极性 (1分)
(3)减小 (1分)
(4)O2 + 2H2O + 4e- = 4OH- (2分)
(5)S2- > K+ > N3- > H+ (2分)
(6)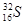 (2分)
(2分)
强于 (1分)
解析试题分析:A元素所处的周期数、主族序数、原子序数均相等,应为H元素,B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3,则B为第二周期第ⅤA族,为N元素;C元素原子的最外层电子数比次外层少2个,应为S元素,C的阴离子与D的阳离子具有相同的电子层结构,两元素可形成化合物D2C,则D为K元素
D为钾元素,B为N元素,原子序数为7,原子核外有2个电子层,最外层电子数位5,则位于第二周期第ⅤA族,
A是 H,B是N,两者都是非金属元素,但两者原子核外电子不同原子半径不同,形成的化学键应为极性共价键。
C为S,其最高价氧化物对应的水化物是硫酸,组成氢氧燃料电池,负极:2H2 -4e- = 4H+;正极:O2 + 4e- + 4H+ = 2H2O;总:2H2+ O2= 2H2O 。负极氢离子不断的增加,PH减小
D为K,最高价氧化物的水化物是氢氧化钾,碱性条件下
负极:2H2+4OH- - 4e-=4H2O 正极:O2+4e-+2H2O=4OH-
同主族元素,随着原子序数增大,离子半径逐渐变大;同周期元素,随着原子序数增大,离子半径逐渐变小。具有相同电子层结构的离子,原子序数越大,离子半径越小。
C元素原子的最高正价为+6价,C的阴离子与D的阳离子具有相同的电子排布,D可与C形成化合物D2C,且C的质子数和中子数相等,所以C为S,同周期元素,氯的非金属性强于硫,所以氯化氢的稳定性强于硫化氢。
考点:考查元素周期表、元素周期律、原电池、离子半径等相关知识。

下列各组粒子所含电子数目相同的是
| A.NH4+、OH-、H3O+ |
| B.Na+、Mg2+、S2- |
| C.F-、NH2-、Cl- |
| D.Li+、Na+、K+ |
(4分)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
| | | | |||||
| | | | a | | | | |
| | b | | c | | | d | |
(1)元素b的基态原子电子排布式为 。
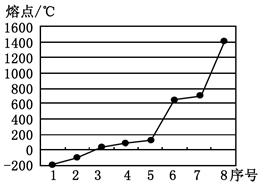
(2)第三周期8种元素按单质熔点高低的排列顺序如右图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填右图中的序号)。
(3)元素a、c分别与元素d形成的化合物中,熔点较高的是(填化学式)。
 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体