题目内容
2.烟道气中的CO2可用于合成甲醇和甲醚.(1)如图所示为其中的一种方法:

①用光电池电解水时,阳极的电极反应式为4OH--4e-═O2↑+2H2O.
②15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,则HOCH2CH2NH3Cl的水溶液显酸(填“酸”“碱”或“中”)性.
③已知,CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.5kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
则工业上以CO2(g)、H2(g)为原料合成CH3OH(l)的热化学方程式为CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9 kJ•mol-1.
(2)将CO2转化为甲醚的反应原理为2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)
①在恒温、恒容的密闭容器中,下列描述能说明上述反应已达化学平衡状态的是bd(填序号).
a.生成1mol CH3OCH3(g)的同时,生成3mol H2O(l)
b.体系中混合气体的密度不随时间而变化
c.体系中CO2与H2的体积比为1:3
d.体系中的气体的总压强不随时间而变化
②已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比$\frac{n{H}_{2}p}{nC{O}_{2}p}$ | 500K | 600K | 700K |
| 1.5 | 45% | 33% | 20% |
| x | a | b | c |
③在一定温度下,向体积为0.5L的密闭容器中加入2mol CO2和6mol H2,20min后达到平衡,测得平衡时CH3OCH3为0.5mol,则该反应的反应速率v(CO2)=0.1mol•L-1•min-1,H2的转化率α(H2)=50%;加入催化剂,v(CO2)增大(填“增大”、“减小”或“不变”,下同),α(H2)不变.
分析 (1)①用光电池电解水时,阳极是氢氧根离子失去电子生产氧气;
②氨基结合水电离平衡中的氢离子,促进水电离平衡正向进行,氢氧根离子浓度增大,溶液显碱性,形成HOCH2CH2NH3Cl的水溶液是阳离子水解,溶液呈酸性;
③依据热化学方程式和盖斯定律计算所得热化学方程式;
(2)①当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,注意选择的物理量应随反应发生变化,该物理量由变化到不变化,说明到达平衡;
②平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,注意水是纯液体不写入表达式,二氧化碳转化率随温度升高减小,说明升温平衡逆向进行,两种反应物增加一种物质的量会提高另一种反应物转化率;
③依据化学平衡三段式列式计算
2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)
起始量(mol) 2 6 0 0
变化量(mol) 1 3 0.5 1.5
平衡量(mol) 1 3 0.5 1.5
反应速率v=$\frac{△c}{△t}$,转化率=$\frac{消耗量}{起始量}$×100%,
催化剂改变反应速率不改变化学平衡分析.
解答 解:(1)①用光电池电解水时,阳极是氢氧根离子失去电子生产氧气,阳极的电极反应式为4OH--4e-═O2↑+2H2O;
故答案为:4OH--4e-═O2↑+2H2O;
②乙醇胺水溶液呈弱碱性是取代基氨基结合氢离子,使溶液中的氢氧根离子浓度增大,反应的离子方程式为:HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-,则HOCH2CH2NH3Cl的水溶液中,HOCH2CH2NH3+水解结合水中的氢氧根离子,促进水的电离,溶液中氢离子浓度增大,溶液显酸性,
故答案为:酸;
③Ⅰ、CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.5kJ•mol-1
Ⅱ、H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
依据盖斯定律计算,Ⅱ×3-Ⅰ得到工业上以CO2(g)、H2(g)为原料合成CH3OH(l)的热化学方程式为CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9 kJ•mol-1 ;
故答案为:CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9 kJ•mol-1 ;
(2)①a.生成1mol CH3CH2OH的同时,生成3mol H2O,反应始终按此比例进行,不能说明到达平衡,故a错误;
b.容器的容积不变,生成物质中水为液体,混合气体的总质量改变,密度不随时间而变化,能说明到达平衡,故b正确;
c.体系中CO2与H2的体积比为1:3,不能说明反应达到平衡状态,故c错误;
d.正反应为气体物质的量减小的反应,容器中气体的压强不随时间而变化,说明到达平衡,故d正确,
故答案为:bd;
②平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,反应的平衡常数K=$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$,
二氧化碳转化率随温度升高减小,说明升温平衡逆向进行,正反应为放热反应,△H<0,两种反应物增加一种物质的量会提高另一种反应物转化率,若使a>45%,x>1.5,
故答案为:$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$,<,>;
③2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)
起始量(mol) 2 6 0 0
变化量(mol) 1 3 0.5 1.5
平衡量(mol) 1 3 0.5 1.5
反应速率v(CO2)=$\frac{△c}{△t}$=$\frac{\frac{1mol}{0.5L}}{20min}$=0.1mol/L•min,
H2的转化率α(H2)=$\frac{消耗量}{起始量}$×100%=$\frac{3mol}{6mol}$×100%=50%,
催化剂改变反应速率不改变化学平衡,加入催化剂加快二氧化碳的反应速率,平衡不移动,氢气转化率不变,
故答案为:0.1;50%;增大;不变.
点评 本题考查了化学平衡的计算分析应用,平衡常数、反应速率,转化率概念计算分析,热化学方程式书写,影响化学平衡的因素分析判断,掌握基础是关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 一种元素可能形成多种氧化物,但同价态的氧化物只有一种 | |
| B. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| C. | 已知K2O、K2O2、KO2的名称依次是氧化钾、过氧化钾、超氧化钾,则BaO2的名称是过氧化钡 | |
| D. | 由共价键形成的物质一定是共价化合物 |
| A. | 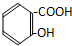 | B. | 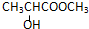 | ||
| C. | CH2=CH-COOH | D. | 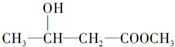 |
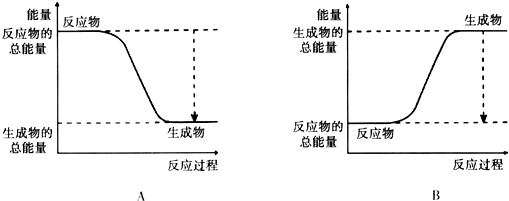
(1)已知该反应为放热反应,下图能正确表示该反应中能量变化的是A.
(2)从断键和成键的角度分析上述反应中能量的变化.已知:化学键的键能:
| 化学键 | H-H | O=O | H-O |
| 键能kJ•mol-1 | 436 | 496 | 463 |
(3)已知1克氢气完全燃烧生成液态水放出QKJ的热量,则氢气燃烧生成液态水的热化学反应方程式为2H2 (g)+O2(g)=2H2O(l)△H=-4QKJ/mol
(4)氢氧燃料电池的总反应方程式为2H2+O2═2H2O.电路中每转移0.2mol电子,标准状况下消耗H2的体积是2.24L.
| A. | 氯化铵与氢氧化钠两种稀溶液混合:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑ | |
| B. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| C. | 氢氧化镁与稀硫酸反应:H++OH-=H2O | |
| D. | 单质铜与稀硝酸反应:Cu+2H++2NO3-=Cu2++2NO↑+H2O |
| A. | 加热蒸干MgCl2饱和溶液,可制得氯化镁固体 | |
| B. | 明矾可用于水的消毒、杀菌 | |
| C. | 使用无磷洗衣粉,可缓解水体富营养化问题 | |
| D. | 用加热法可除去硬水中的CaCl2、MgCl2 |
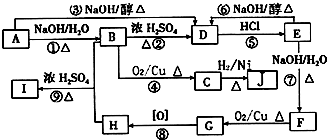
 C中含氧官能团的名称为羰基.
C中含氧官能团的名称为羰基. .G与新制Cu(OH)2悬浊液反应的化学方程式
.G与新制Cu(OH)2悬浊液反应的化学方程式 .
.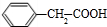 +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$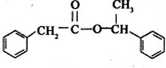 +H2O
+H2O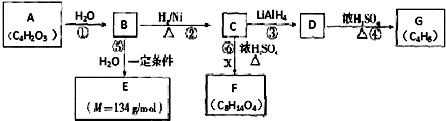
 .
. .
.