题目内容
7.如图1是多种无机物在一定条件下的转化关系(部分产物及反应条件未列出.)H是形成光化学烟雾及形成酸雨的一种主要气体,K为第三周期元素组成的单质熔点最高的金属,FeS2是一种矿石的主要成份,常用来生产一种重要的强酸.回答:(1)组成单质M的元素位于元素周期表的位置第四周期Ⅷ族
(2)写出反应④的离子方程式:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
(3)写出⑦的化学反应方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3
(4)已知:t℃时,2H (g)+Y (g)═2I (g);△H=-196.6kJ/mol.
①若t℃时,在一压强恒定的密闭容器中,加入4molH和2molY反应,达到平衡后,放出354kJ的热量,则Y的转化率约为90%(用百分数表示).
②若图2为恒容条件下,上述反应的正反应速率随时间的变化示意图(每一时刻都各改变一种不同的条件),若t5时降压,t6时达平衡,请在图中画出t5~t7时的变化曲线.
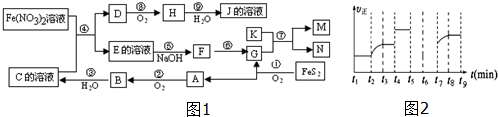
分析 由反应4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2知A、G为Fe2O3、SO2中的一种,结合A+O2 →B知,A为SO2,G为Fe2O3,B为SO3,C为H2SO4;由K为第三周期中熔点最高的金属知K为Al;M、N为Al2O3和Fe中的一种;由H是形成光化学烟雾及形成酸雨的一种主要气体可知H为NO2,J为HNO3,D为NO;E为Fe(NO3)3或Fe2(SO4)3;F为应为Fe(OH)3,由(1)可知M为单质,则M为Fe,N为Al2O3,以此解答该题.
解答 解:由反应4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2知A、G为Fe2O3、SO2中的一种,结合A+O2 →B知,A为SO2,G为Fe2O3,B为SO3,C为H2SO4;由K为第三周期中熔点最高的金属知K为Al;M、N为Al2O3和Fe中的一种;由H是形成光化学烟雾及形成酸雨的一种主要气体可知H为NO2,J为HNO3,D为NO;E为Fe(NO3)3或Fe2(SO4)3;F为应为Fe(OH)3,由(1)可知M为单质,则M为Fe,N为Al2O3,
(1)M为铁,位于周期表第四周期Ⅷ族,故答案为:第四周期Ⅷ族;
(2)反应④的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,
故答案为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
(3)反应⑦为铝热反应,方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(4)①依据加入4molH和2molY反应,达到平衡后,放出354KJ的热量,计算反应达到平衡后消耗的Y物质的量=$\frac{354kJ}{196.6kJ/mol}$=1.8mol;化学平衡的三段式计算列式计算;
2H(g)+Y(g)?2I(g);△H=-196.6KJ/mol.
起始量(mol) 4 2 0
变化量(mol) 3.6 1.8 3.6
平衡量(mol) 0.4 0.2 3.6
平衡后Y的转化率=$\frac{1.8}{2}$×100%=90%,
故答案为:90%;
②若t5时降压,则反应速率减小,图象为 ,故答案为:
,故答案为: .
.
点评 本题考查无机物的推断,题目难度中等,本题注意根据FeS2与氧气反应的性质结合物质的反应特点和物质的物理性质,如颜色、状态等,先确定个别物质,根据框图寻找线索进行推断.

| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+ $\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| B. | 用银氨溶液检验乙醛中的醛基: CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COONH4+3NH3+2Ag↓+H2O | |
| C. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2+ 3H2O | |
| D. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- |
| A. | 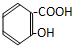 | B. | 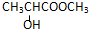 | ||
| C. | CH2=CH-COOH | D. | 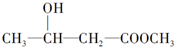 |
| A. | 氯化铵与氢氧化钠两种稀溶液混合:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑ | |
| B. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| C. | 氢氧化镁与稀硫酸反应:H++OH-=H2O | |
| D. | 单质铜与稀硝酸反应:Cu+2H++2NO3-=Cu2++2NO↑+H2O |
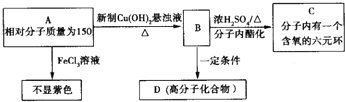
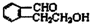 ;
;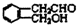 .
. ;此A对应的B生成C的反应:
;此A对应的B生成C的反应: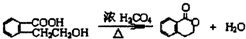 .
.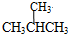 和
和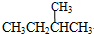 ;⑦
;⑦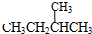 和
和
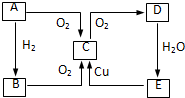 在图中A、B、C、D、E中均含有硫元素,通常状况下,A为固体单质,根据右图的转化关系,回答:
在图中A、B、C、D、E中均含有硫元素,通常状况下,A为固体单质,根据右图的转化关系,回答: ,共价键
,共价键