题目内容
20.A、B、C、D、E、F为原子序数依次增大的六种短周期主族元素.D、E同主族,B的一种核素在考古时常用来鉴定一些文物的年代;D元素原子的最外层电子数是内层的3倍,A和D可形成两种常见的化合物甲和乙(相对分子质量甲<乙).请回答下列问题:(1)F的元素对应简单离子的离子结构示意图
 ,E元素的周期表位置第三周期ⅥA族,乙的电子式为
,E元素的周期表位置第三周期ⅥA族,乙的电子式为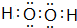 .
.(2)由A、B、C、D四种元素所形成离子化合物的化学式NH4HCO3、(NH4)2CO3等.
(3)由上述六种元素中的某些元素组成的物质中,请举出一例互为同分异构体关系的物质(填写名称)金刚石、石墨.
(4)E、F两元素的非金属性强弱顺序是Cl>S(用元素符号填空),写出能证明该强弱顺序的实验事实是Cl2+H2S=S↓+2HCl等.
(5)D、E的氢化物中沸点较高的是H2O(填化学式),理由是由于水分子间形成氢键,导致沸点升高.
分析 A、B、C、D、E、F为原子序数依次增大的六种短周期主族元素,B的一种核素在考古时常用来鉴定一些文物的年代,则B为碳元素;D元素原子的最外层电子数是内层的3倍,原子只能有2个电子层,最外层电子数为6,故D为氧元素;C的原子序数介于碳、氧之间,所以C为氮元素;D、E同主族,则E为S元素,可推知F为Cl元素;A和D可形成两种常见的化合物甲和乙(相对分子质量甲<乙),则A为H元素,甲为H2O、乙为H2O2,据此解答.
解答 解:A、B、C、D、E、F为原子序数依次增大的六种短周期主族元素,B的一种核素在考古时常用来鉴定一些文物的年代,则B为碳元素;D元素原子的最外层电子数是内层的3倍,原子只能有2个电子层,最外层电子数为6,故D为氧元素;C的原子序数介于碳、氧之间,所以C为氮元素;D、E同主族,则E为S元素,可推知F为Cl元素;A和D可形成两种常见的化合物甲和乙(相对分子质量甲<乙),则A为H元素,甲为H2O、乙为H2O2.
(1)F的元素对应简单离子为Cl-,离子结构示意图为 ,E为S元素,处于周期表中第三周期ⅥA族,乙为H2O2,电子式为
,E为S元素,处于周期表中第三周期ⅥA族,乙为H2O2,电子式为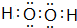 ,
,
故答案为: ;第三周期ⅥA族;
;第三周期ⅥA族;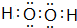 ;
;
(2)由H、C、N、O四种元素所形成离子化合物的化学式为:NH4HCO3、(NH4)2CO3等,
故答案为:NH4HCO3、(NH4)2CO3等;
(3)由上述六种元素中的某些元素组成的物质中,一例互为同分异构体关系的物质为:金刚石、石墨等,
故答案为:金刚石、石墨;
(4)同周期自左而右非金属性增强,故非金属性Cl>S,证明该强弱顺序的实验事实是:Cl2+H2S=S↓+2HCl等,
故答案为:Cl>S;Cl2+H2S=S↓+2HCl等;
(5)由于水分子间形成氢键,故沸点高于H2S,
故答案为:H2O;由于水分子间形成氢键,导致沸点升高.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意理解掌握金属性、非金属性强弱比较实验事实.

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案| A. | 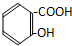 | B. | 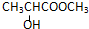 | ||
| C. | CH2=CH-COOH | D. | 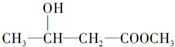 |
| A. | 纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 | |
| B. | 鱼虾会产生不愉快的腥臭味,可在烹调时加入少量食醋和料酒 | |
| C. | 被蜂蚁蜇咬会感觉疼痛难忍,这是由于人的皮肤被注入了甲酸的缘故,此时若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 | |
| D. | 苯酚溶液可用于环境消毒,医用酒精可用于皮肤消毒,其原因均在于可使蛋白质变性凝固 |
| A. | 常温常压下,2.24L 氯气与氢氧化钠溶液完全反应转移的电子数为0.1NA | |
| B. | 标准状况下,1L辛烷完全燃烧后,所生成气体产物的分子数为8NA/22.4 | |
| C. | 0.1L 2mol•L-1的(NH4)2S溶液中含有的S2-数目为0.2 NA | |
| D. | 在含有4mol Si-O键的石英晶体中,氧原子的数目为2NA |
| A. | 向Fe(NO3)2稀溶液中加入稀盐酸:Fe2++2H++NO3-═Fe3++NO2↑+H2O | |
| B. | 向NaHSO4溶液中加入过量的Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 向(NH4)2Mg(SO4)2溶液中加入少量的Na2O:Mg2++Na2O+H2O═Mg(OH)2↓+2Na+ | |
| D. | 向0.1mol•L-1、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-═A2-+H2O |
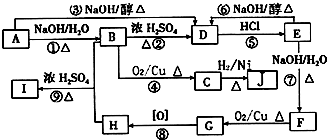
 C中含氧官能团的名称为羰基.
C中含氧官能团的名称为羰基. .G与新制Cu(OH)2悬浊液反应的化学方程式
.G与新制Cu(OH)2悬浊液反应的化学方程式 .
.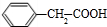 +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$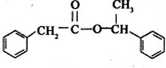 +H2O
+H2O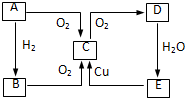 在图中A、B、C、D、E中均含有硫元素,通常状况下,A为固体单质,根据右图的转化关系,回答:
在图中A、B、C、D、E中均含有硫元素,通常状况下,A为固体单质,根据右图的转化关系,回答: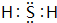 ,共价键
,共价键
 .
. .
.