题目内容
19.下列说法正确的是( )| A. | 标准状况下,将1.12L Cl2溶于水,转移电子数为0.05NA | |
| B. | 将含等物质的量的KHCO3和Ba(OH)2溶液混合,离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| C. | 常温下,由水电离出的H+浓度为10-13mol•L-1的溶液中,Fe2+、Cl-、Na+、NO3-一定能大量共存 | |
| D. | 葡萄糖(C6H12O6)溶液中:SO42-、MnO4-、K+、H+可以大量共存 |
分析 A.氯气溶于水,只有部分氯气与水反应生成氯化氢和次氯酸;
B.二者物质的量相等,氢氧根离子过量,反应生成碳酸钡沉淀、氢氧化钾和水;
C.该溶液为酸性或碱性溶液,亚铁离子与氢氧根离子反应,硝酸根离子在酸性条件下能够氧化亚铁离子;
D.酸性高锰酸钾溶液能够够氧化葡萄糖.
解答 解:A.标况下1.12L氯气的物质的量为0.05mol,0.05mol氯气与水反应,只有部分氯气参与反应,则反应转移的电子小于0.05mol,故A错误;
B.将含等物质的量的KHCO3和Ba(OH)2溶液混合,二者反应生成碳酸钡沉淀、氢氧化钾和水,反应的离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O,故B正确;
C.温下,由水电离出的H+浓度为10-13mol•L-1的溶液为酸性或碱性溶液,Fe2+与氢氧根离子反应,酸性溶液中Fe2+、NO3-之间发生氧化还原反应,在溶液中一定不能大量共存,故C错误;
D.MnO4-、H+具有强氧化性,能够氧化葡萄糖(C6H12O6),在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存、离子方程式的书写判断、氧化还原反应的计算,题目难度中等,注意掌握离子反应发生条件,明确离子方程式、离子共存的判断方法,明确氯气与水的反应情况,为易错点.

练习册系列答案
相关题目
1.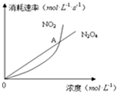 在80℃时,将0.40mol 的N2O4气体充入2L 已经抽成真空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H=+56.9kJ/mol,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,将0.40mol 的N2O4气体充入2L 已经抽成真空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H=+56.9kJ/mol,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)计算在80℃时该反应的平衡常数K=1.8.
(2)反应进行至100s 后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”).
(3)要增大该反应的K值,可采取的措施有D(填序号).
A.增大N2O4起始浓度 B.向混合气体中通入NO2C.使用高效催化剂 D.升高温度
(4)当反应达到平衡后,下列操作,不能使平衡混合气体颜色加深的是D
A.恒温恒容下再通入N2O4气体
B.恒温恒容下再通入NO2气体
C.恒容时,升高温度
D.恒温恒容时通入Ar
E.恒温时压缩体积
(5)图中,交点A表示该反应的所处的状态为B
A.平衡状态 B.朝正反应方向移动C.朝逆反应方向移动 D.无法判断.
 在80℃时,将0.40mol 的N2O4气体充入2L 已经抽成真空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H=+56.9kJ/mol,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,将0.40mol 的N2O4气体充入2L 已经抽成真空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H=+56.9kJ/mol,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(2)反应进行至100s 后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”).
(3)要增大该反应的K值,可采取的措施有D(填序号).
A.增大N2O4起始浓度 B.向混合气体中通入NO2C.使用高效催化剂 D.升高温度
(4)当反应达到平衡后,下列操作,不能使平衡混合气体颜色加深的是D
A.恒温恒容下再通入N2O4气体
B.恒温恒容下再通入NO2气体
C.恒容时,升高温度
D.恒温恒容时通入Ar
E.恒温时压缩体积
(5)图中,交点A表示该反应的所处的状态为B
A.平衡状态 B.朝正反应方向移动C.朝逆反应方向移动 D.无法判断.
2.下列化合物中,既有酸性又能发生酯化反应和消去反应的是( )
| A. | 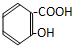 | B. | 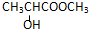 | ||
| C. | CH2=CH-COOH | D. | 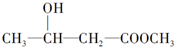 |
7.下列离子方程式正确的是( )
| A. | 氯化铵与氢氧化钠两种稀溶液混合:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑ | |
| B. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| C. | 氢氧化镁与稀硫酸反应:H++OH-=H2O | |
| D. | 单质铜与稀硝酸反应:Cu+2H++2NO3-=Cu2++2NO↑+H2O |
14.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 加热蒸干MgCl2饱和溶液,可制得氯化镁固体 | |
| B. | 明矾可用于水的消毒、杀菌 | |
| C. | 使用无磷洗衣粉,可缓解水体富营养化问题 | |
| D. | 用加热法可除去硬水中的CaCl2、MgCl2 |
8.“化学无处不在”,下列与化学有关的说法不正确的是( )
| A. | 纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 | |
| B. | 鱼虾会产生不愉快的腥臭味,可在烹调时加入少量食醋和料酒 | |
| C. | 被蜂蚁蜇咬会感觉疼痛难忍,这是由于人的皮肤被注入了甲酸的缘故,此时若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 | |
| D. | 苯酚溶液可用于环境消毒,医用酒精可用于皮肤消毒,其原因均在于可使蛋白质变性凝固 |
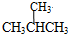 和
和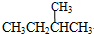 ;⑦
;⑦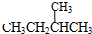 和
和
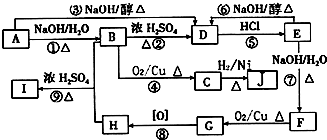
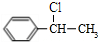 C中含氧官能团的名称为羰基.
C中含氧官能团的名称为羰基.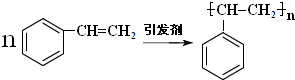 .G与新制Cu(OH)2悬浊液反应的化学方程式
.G与新制Cu(OH)2悬浊液反应的化学方程式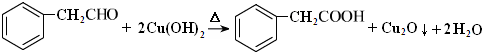 .
.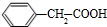 +
+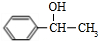 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$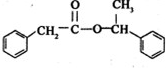 +H2O
+H2O