题目内容
5.下列有机物名称正确的是( )| A. | 2-乙基戊烷 | B. | 1,2-二甲基丁烷 | ||
| C. | 3,3-二甲基-1-丁稀 | D. | 3,4-二甲基戊烷 |
分析 A、烷烃命名时,应选最长的碳链为主链,从离支链近额一端开始编号;
B、烷烃命名时,应选最长的碳链为主链;
C、烯烃命名时,选含官能团的最长碳链为主链,从离官能团近的一端开始编号;
D、烷烃命名时,应选最长的碳链为主链,从离支链近额一端开始编号.
解答 解:A、2-乙基戊烷,烷烃的命名中出现2-乙基,说明选取的主链不是最长碳链,该有机物最长碳链含有6个C,主链为己烷,其正确命名为:3-甲基己烷,故A错误;
B、烷烃命名时,应选最长的碳链为主链,故主链上有5个碳原子,在2号碳上有一个甲基,故正确的名称为2-甲基戊烷,故B错误;
C、烯烃命名时,选含官能团的最长碳链为主链,故主链上有4个碳原子,从离官能团近的一端开始编号,则在3号碳上有2个甲基,用编号较小的碳原子表示官能团的位置,故名称为:3,3-二甲基-1-丁烯,故C正确;
D、3,4-二甲基戊烷,该命名中取代基的编号之和不是最小,说明编号的方向错误,正确命名应该为:2,3-二甲基戊烷,故D错误;
故选C.
点评 本题考查了有机物的命名,题目难度不大,该题注重了基础性试题的考查,侧重对学生基础知识的检验和训练,该题的关键是明确有机物的命名原则,然后结合有机物的结构简式灵活运用即可,有利于培养学生的规范答题能力.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
15.一位患者镶了两颗假牙,其中一颗是黄金的,另一颗是不锈钢的.自镶上假牙后,他时感头疼,心情烦躁,多次治疗未见好转.如果你是医生,下列方法不能治疗其疾病的是( )
| A. | 将两颗假牙都做成黄金的 | B. | 将两颗假牙都做成不锈钢的 | ||
| C. | 将金假牙改为铝质假牙 | D. | 将两颗假牙都做成特殊树脂的 |
16.碘硫化学循环原理如图1所示.
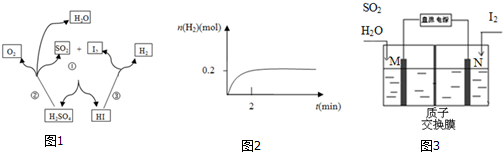
(1)写出反应③的化学方程式2HI$\stackrel{△}{?}$H2+I2,一定温度下,向2L密闭容器中加入2mol HI(g),测得n (H2)随时间的变化如图2所示,则该温度下该反应的平衡常数K=$\frac{1}{64}$.
(2)写出反应①的化学方程式I2+SO2+2H2O=2HI+H2SO4,其中SO2体现的是还原性.
(3)综合①②③三个反应,可看出该化学循环是为了制备某种能源气体,该气体的化学式是H2.
(4)氧缺位铁酸铜(CuFe2O4-δ)是反应②的良好的催化剂.实验室用如下方法制得:
Ⅰ.在Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液,加热
Ⅱ.调节pH并连续搅拌24小时
Ⅲ.过滤、干燥获得铁酸铜(CuFe2O4)
Ⅳ.在氮气保护下、1223K时煅烧CuFe2O4,得到CuFe2O3.86
①写出制备得到CuFe2O4的化学方程式2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O
②研究发现:
计算CuFe2O3.86中Fe3+与Fe2+的质量百分含量之比为43:7.
(5)由于该循环中H2SO4与HI发生副反应造成反应器堵塞,因此有科学家用如图3所示原理进行反应.写出阳极的电极反应式SO2+2H2O-2e-=4H++SO42-.请用文字说明在N极能够获得所需物质的原因是M极附近产生的H+通过质子交换膜移动到N极附近,与I2失电子后得到的I-形成HI溶液.

(1)写出反应③的化学方程式2HI$\stackrel{△}{?}$H2+I2,一定温度下,向2L密闭容器中加入2mol HI(g),测得n (H2)随时间的变化如图2所示,则该温度下该反应的平衡常数K=$\frac{1}{64}$.
(2)写出反应①的化学方程式I2+SO2+2H2O=2HI+H2SO4,其中SO2体现的是还原性.
(3)综合①②③三个反应,可看出该化学循环是为了制备某种能源气体,该气体的化学式是H2.
(4)氧缺位铁酸铜(CuFe2O4-δ)是反应②的良好的催化剂.实验室用如下方法制得:
Ⅰ.在Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液,加热
Ⅱ.调节pH并连续搅拌24小时
Ⅲ.过滤、干燥获得铁酸铜(CuFe2O4)
Ⅳ.在氮气保护下、1223K时煅烧CuFe2O4,得到CuFe2O3.86
①写出制备得到CuFe2O4的化学方程式2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O
②研究发现:
| 温度 | 元素存在形式 |
| 1200-1350K | Fe3+部分转变为Fe2+ |
(5)由于该循环中H2SO4与HI发生副反应造成反应器堵塞,因此有科学家用如图3所示原理进行反应.写出阳极的电极反应式SO2+2H2O-2e-=4H++SO42-.请用文字说明在N极能够获得所需物质的原因是M极附近产生的H+通过质子交换膜移动到N极附近,与I2失电子后得到的I-形成HI溶液.
13.某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00mL,大理石用量为10.00g.
请完成以下实验设计表,并在实验目的一栏中填空:
请完成以下实验设计表,并在实验目的一栏中填空:
| 实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响;(Ⅱ)实验①和③探究温度对反应速率的影响;(Ⅲ)实验①和④探究大理石规格(粗、细)对反应速率的影响. |
| ② | ||||
| ③ | ||||
| ④ |
20.将Fe、FeO和Fe2O3的混合物m g加入足量的盐酸中充分反应后,固体无剩余,测得参加反应的HCl为0.08mol,放出的气体在标准状况下的体积为0.224L,则原混合物中氧元素的质量分数为( )
| A. | 20.5% | B. | 18.6% | C. | 17.6% | D. | 无法计算 |
10.COCl2分子的结构式为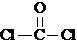 ,COCl2分子内含有( )
,COCl2分子内含有( )
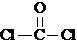 ,COCl2分子内含有( )
,COCl2分子内含有( )| A. | 4个σ键 | B. | 2个σ键、2个π键 | C. | 2个σ键、1个π键 | D. | 3个σ键、1个π键 |
17.以NA表示阿伏加德罗常数,则下列说法正确的是( )
| A. | 1 mol NH3分子中含有3NA个σ键和4NA个sp3杂化轨道 | |
| B. | 1 mol CO2分子中含有2NA个σ键和2NA个sp2杂化轨道 | |
| C. | 1 mol C2H2分子中含有2NA个σ键、2NA个π键 | |
| D. | 1 mol C2H4分子中含有4NA个σ键、2NA个π键 |
15.已知烯烃、炔烃在臭氧的作用下发生以下反应:
CH3-CH═CH-CH2-CH═CH2→CH3CHO+OHC-CH2-CHO+HCHO
CH3-C≡C-CH2-C≡CH-→CH3COOH+HOOCCH2COOH+HCOOH 某烃分子式为C10H10,在臭氧作用下发生反应:C10H10→CH3COOH+3HOOC-CHO+CH3CHO,
下列判断正确在是( )
CH3-CH═CH-CH2-CH═CH2→CH3CHO+OHC-CH2-CHO+HCHO
CH3-C≡C-CH2-C≡CH-→CH3COOH+HOOCCH2COOH+HCOOH 某烃分子式为C10H10,在臭氧作用下发生反应:C10H10→CH3COOH+3HOOC-CHO+CH3CHO,
下列判断正确在是( )
| A. | 其结构中含有4个碳碳双键,4个碳碳三键 | |
| B. | 分子中含有4个碳碳双键和2个碳碳三键 | |
| C. | 该烃结构简式是:CH3-C≡C-CH=CH-C≡C-CH=CH-CH3 | |
| D. | 其结构中含有2个碳碳双键,4个碳碳三键 |
