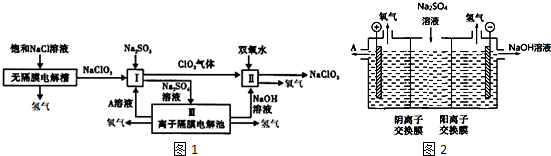
题目内容
13.某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00mL,大理石用量为10.00g.请完成以下实验设计表,并在实验目的一栏中填空:
| 实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响;(Ⅱ)实验①和③探究温度对反应速率的影响;(Ⅲ)实验①和④探究大理石规格(粗、细)对反应速率的影响. |
| ② | ||||
| ③ | ||||
| ④ |
分析 根据实验目的“(Ⅰ)实验①和②探究浓度对反应速率的影响、(Ⅱ)实验①和③探究温度对反应速率的影响”及变量唯一性判断实验②③的反应条件;实验①和④探究应该探究大理石规格对反应速率的影响,据此解答④的反应条件.
解答 解:实验①和②探究浓度对反应速率的影响,则反应温度、大理石规格必须相同,只有硝酸的浓度不同;实验①③探究温度对反应速率的影响,则只有温度不同,其它条件完全相同;实验①④应该是探究大理石规格对反应速率的影响,则两个实验中应该只有大理石规格不同,据此完成表格为:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L-1 | 实验目的 |
| ① | 大理石规格(粗、细) | |||
| ② | 298 | 粗颗粒 | 1.00 | |
| ③ | 308 | 粗颗粒 | 2.00 | |
| ④ | 298 | 细颗粒 | 2.00 |
故答案为:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L-1 | 实验目的 |
| ① | 大理石规格(粗、细) | |||
| ② | 298 | 粗颗粒 | 1.00 | |
| ③ | 308 | 粗颗粒 | 2.00 | |
| ④ | 298 | 细颗粒 | 2.00 |
点评 本题考查了探究影响化学法反应速率的因素,题目难度中等,明确对照实验设计方法为解答关键,注意掌握影响化学反应速率的因素,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
3.下列说法中正确的是( )
| A. | 同一周期元素的原子,半径越小越容易失去电子 | |
| B. | 在同一周期中,ⅠA族单质的活泼性比ⅡA族的弱 | |
| C. | 所有主族元素的最高化合价数与它的族序数数值相等 | |
| D. | 同主族元素的气态氢化物,相对分子质量越大,沸点不一定越高 |
8.软锰矿(主要成分为Mn02)可用于制备锰及其化合物.
(1)早期冶炼金属锰的一种方法是先缎烧软锰矿生成Mn304,再利用铝热反应原理由Mn3O4制备锰.该铝热反应的化学方程式为8Al+3Mn3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Mn
(2)现代冶炼金属锰的一种工艺流程如图所示:

下表t℃时,有关物质的pKap(注pKap=-1Kap).
①软锰矿还原浸出的反应为:12MnO2+C6H12O6+12H2SO4═12MnSO4+6CO2↑+18H2O
该反应中,还原剂为C6H12O6.写出一种能提高还原浸出速率的措施:升高反应温度或将软锰矿研细等
②滤液1的pH>(填“>”“<”或“=”)MnS04浸出液的pH.
③加入MnF2的目的是除去Ca2+(填“Ca2+”“Fe3+”或“Cu2+”).
(3)由MnS04制取MnC03.往MnS04溶液中加人NH4HC03溶液,析出MnC03沉淀并逸出C02气体,该反应的离子方程式为Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;若往MnS04溶液中加人(NH4)2C03溶液,还会产生Mn(OH) 2,可能的原因有:MnCO3(s)+2OH-(aq)?Mn(OH)2(s)+CO32-(aq),t℃时,该反应的平衡常数K=100(填数值).
(1)早期冶炼金属锰的一种方法是先缎烧软锰矿生成Mn304,再利用铝热反应原理由Mn3O4制备锰.该铝热反应的化学方程式为8Al+3Mn3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Mn
(2)现代冶炼金属锰的一种工艺流程如图所示:

下表t℃时,有关物质的pKap(注pKap=-1Kap).
| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKap | 37.4 | 19.3 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
该反应中,还原剂为C6H12O6.写出一种能提高还原浸出速率的措施:升高反应温度或将软锰矿研细等
②滤液1的pH>(填“>”“<”或“=”)MnS04浸出液的pH.
③加入MnF2的目的是除去Ca2+(填“Ca2+”“Fe3+”或“Cu2+”).
(3)由MnS04制取MnC03.往MnS04溶液中加人NH4HC03溶液,析出MnC03沉淀并逸出C02气体,该反应的离子方程式为Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;若往MnS04溶液中加人(NH4)2C03溶液,还会产生Mn(OH) 2,可能的原因有:MnCO3(s)+2OH-(aq)?Mn(OH)2(s)+CO32-(aq),t℃时,该反应的平衡常数K=100(填数值).
5.下列有机物名称正确的是( )
| A. | 2-乙基戊烷 | B. | 1,2-二甲基丁烷 | ||
| C. | 3,3-二甲基-1-丁稀 | D. | 3,4-二甲基戊烷 |
2.前不久,我国科学家合成了三种新核素,其中一种是185Hf.下列关于18572Hf的叙述中正确的是( )
| A. | 该元素的原子序数是72 | B. | 该元素的原子序数是185 | ||
| C. | 该原子相对原子质量是185 | D. | 该元素是一种新元素 |
3.下列说法错误的是( )
| A. | 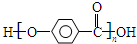 的结构中含有酯基 的结构中含有酯基 | |
| B. | 甲基的电子式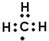 | |
| C. | 顺-2-丁烯和反-2-丁烯的加氢产物不同 | |
| D. | 用重结晶的方法提纯苯甲酸时应趁热过滤 |