题目内容
10.COCl2分子的结构式为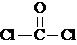 ,COCl2分子内含有( )
,COCl2分子内含有( )| A. | 4个σ键 | B. | 2个σ键、2个π键 | C. | 2个σ键、1个π键 | D. | 3个σ键、1个π键 |
分析 分子中含有C=O键、C-Cl键,其中C=O中含有1个δ键,1个π键,以此解答该题.
解答 解:COCl2分子的结构式为: ,分子中含有2个单键和1个双键,则COCl2分子内含有3个σ键、1个π键,
,分子中含有2个单键和1个双键,则COCl2分子内含有3个σ键、1个π键,
故选D.
点评 本题考查化学键及共价化合物,为高频考点,把握化学键形成的一般规律为解答的关键,注意常见物质中的化学键,注重基础知识的考查,题目难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
20.下列叙述中,不能用平衡移动原理解释的是( )
| A. | 红棕色的NO2,加压后颜色先变深后变浅 | |
| B. | 高压比常压有利于合成SO3的反应 | |
| C. | 由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
5.下列有机物名称正确的是( )
| A. | 2-乙基戊烷 | B. | 1,2-二甲基丁烷 | ||
| C. | 3,3-二甲基-1-丁稀 | D. | 3,4-二甲基戊烷 |
15. 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
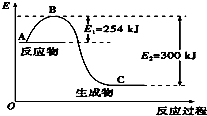
(1)如图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,A代表的含义代表反应物的总能量A与C差值代表的含义代表反应热的大小.请写出N2和H2反应的热化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92KJ/mol.反应过程中加入正向催化剂,E1和E2变化情况变小(变大,变小,不变),△H变化情况不变(变大,变小,不变)假设此反应在密闭容器中反应过程中活化分子百分数变化情况变大(变大,变小,不变).
(2)若已知下列数据
试根据表中及图中数据计算N-H的键能为390kJ•mol-1.
(3)用NH3催化还原NOx还可以消除氮氧化物的污染.
例如:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H1=-a kJ•mol-1 ①
N2(g)+O2(g)═2NO(g)△H2=-b kJ•mol-1 ②
若1mol NH3还原NO至N2,并生成水蒸气,则该反应过程中的反应热△H3=$\frac{(3b-a)}{4}$kJ•mol-1(用含a、b的式子表示).
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.(1)如图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,A代表的含义代表反应物的总能量A与C差值代表的含义代表反应热的大小.请写出N2和H2反应的热化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92KJ/mol.反应过程中加入正向催化剂,E1和E2变化情况变小(变大,变小,不变),△H变化情况不变(变大,变小,不变)假设此反应在密闭容器中反应过程中活化分子百分数变化情况变大(变大,变小,不变).
(2)若已知下列数据
| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
(3)用NH3催化还原NOx还可以消除氮氧化物的污染.
例如:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H1=-a kJ•mol-1 ①
N2(g)+O2(g)═2NO(g)△H2=-b kJ•mol-1 ②
若1mol NH3还原NO至N2,并生成水蒸气,则该反应过程中的反应热△H3=$\frac{(3b-a)}{4}$kJ•mol-1(用含a、b的式子表示).
2.前不久,我国科学家合成了三种新核素,其中一种是185Hf.下列关于18572Hf的叙述中正确的是( )
| A. | 该元素的原子序数是72 | B. | 该元素的原子序数是185 | ||
| C. | 该原子相对原子质量是185 | D. | 该元素是一种新元素 |
19.难溶电解质AB2的饱和溶液中[A2+]=x mol•L-1,[B-]=y mol•L-1,则Ksp值为( )
| A. | 0.5xy2 | B. | xy | C. | xy2 | D. | 4xy2 |
20.居里夫人发现的镭是主族元素,镭原子核存有7个电子层,最外层上只有2个电子,下列关于它的描述中错误的是( )
| A. | 在化合物中呈现+2价 | B. | 它的氢氧化物呈两性 | ||
| C. | 原子半径在本族元素中最大 | D. | 单质与水反应能放出氢气 |