题目内容
【题目】三氯化六氨合钴(Ⅲ)是一种重要的配合物原料,实验室制备实验流程如下:
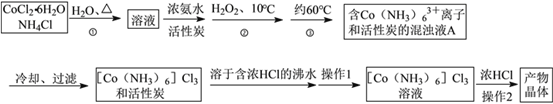
已知:[Co(NH3)6]Cl3在水中电离为[Co(NH3)6]3+和Cl-,[Co(NH3)6]Cl3的溶解度如下表:
温度(℃) | 0 | 20 | 47 |
溶解度(g) | 4.26 | 6.96 | 12.74 |
(1)第①步需在煮沸NH4Cl溶液中加入研细的CoCl2·6H2O晶体,加热煮沸与研细的目的是__
(2)实验室制备三氯化六氨合钴(III)的化学方程式为:____________
(3)实验操作1为 _________[Co(NH3)6]Cl3溶液中加入浓盐酸的目的是_____
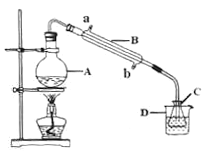
(4)现称取0.2675g[Co(NH3)6]Cl3(相对分子质量为267.5),在A中发生如下反应:[Co(NH3)6]Cl3+3NaOH![]() Co(OH)3↓+6NH3↑+3NaCl(装置见右下图),C中装0.5000mol·L-1的盐酸25.00mL,D中装有冰水。加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端外壁上粘附的酸液于C中,加入2-3滴甲基红指示剂,用0.5000mol·L-1的NaOH滴定。
Co(OH)3↓+6NH3↑+3NaCl(装置见右下图),C中装0.5000mol·L-1的盐酸25.00mL,D中装有冰水。加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端外壁上粘附的酸液于C中,加入2-3滴甲基红指示剂,用0.5000mol·L-1的NaOH滴定。
已知: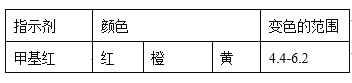
①当滴定到终点时,共需消耗NaOH溶液___mL(准确到0.01mL)。
②当用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,则x值将______(填“偏大”、“偏小”或“不变”)
【答案】 加速固体的溶解 实验室制备三氯化六氨合钴(III)的化学方程式为:2CoCl2·6H2O + 10NH3+ 2NH4Cl + H2O2 ![]() 2[Co(NH3)6]Cl3+14H2O 趁热过滤 有利于[Co(NH3)x]Cl3析出,提高产率 13.00 偏大
2[Co(NH3)6]Cl3+14H2O 趁热过滤 有利于[Co(NH3)x]Cl3析出,提高产率 13.00 偏大
【解析】(1)第①步需在煮沸NH4Cl溶液中加入研细的CoCl2·6H2O晶体,加热煮沸与研细的目的是加速固体的溶解;(2)实验室制备三氯化六氨合钴(III)的化学方程式为:2CoCl2·6H2O + 10NH3+ 2NH4Cl + H2O2 ![]() 2[Co(NH3)6]Cl3+14H2O ;(3)流程图提供的信息可知,实验操作Ⅰ为趁热过滤;[Co(NH3)6]Cl3溶液中加入浓盐酸的目的是:[Co(NH3)6]Cl3 溶液中加入浓HCl增大氯离子浓度,依据沉淀溶解平衡理论,平衡向析出晶体的方向移动,所以加入浓盐酸的目的是有利于[Co(NH3)6]Cl3析出,提高产率;(4)0.2675g[Co(NH3)6]Cl3(相对分子质量为267.5),物质的量=0.2675g/267.5g·mol-1=0.001mol,滴定过程分析发生的反应依次为[Co(NH3)6]Cl3+3NaOH═Co(OH)3↓+6NH3↑+3NaCl,NH3+HCl=NH4Cl,HCl+NaOH=NaCl+H2O,放出氨气物质的量总计为0.006mol,消耗HCl物质的量0.006mol,HCl总物质的量=0.0250L×0.5mol·L-1=0.0125mol,所以消耗剩余HCl需要氢氧化钠物质的量=0.0125mol-0.006mol=0.0065mol,当滴定到终点时,共消耗NaOH溶液的体积=0.0065mol/0.5mol·L-1=0.0013L=13.00ml;②当用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,导致酸液减少,消耗氢氧化钠的量减少,测定氨气量增多,x值将偏大。
2[Co(NH3)6]Cl3+14H2O ;(3)流程图提供的信息可知,实验操作Ⅰ为趁热过滤;[Co(NH3)6]Cl3溶液中加入浓盐酸的目的是:[Co(NH3)6]Cl3 溶液中加入浓HCl增大氯离子浓度,依据沉淀溶解平衡理论,平衡向析出晶体的方向移动,所以加入浓盐酸的目的是有利于[Co(NH3)6]Cl3析出,提高产率;(4)0.2675g[Co(NH3)6]Cl3(相对分子质量为267.5),物质的量=0.2675g/267.5g·mol-1=0.001mol,滴定过程分析发生的反应依次为[Co(NH3)6]Cl3+3NaOH═Co(OH)3↓+6NH3↑+3NaCl,NH3+HCl=NH4Cl,HCl+NaOH=NaCl+H2O,放出氨气物质的量总计为0.006mol,消耗HCl物质的量0.006mol,HCl总物质的量=0.0250L×0.5mol·L-1=0.0125mol,所以消耗剩余HCl需要氢氧化钠物质的量=0.0125mol-0.006mol=0.0065mol,当滴定到终点时,共消耗NaOH溶液的体积=0.0065mol/0.5mol·L-1=0.0013L=13.00ml;②当用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,导致酸液减少,消耗氢氧化钠的量减少,测定氨气量增多,x值将偏大。

 名校课堂系列答案
名校课堂系列答案【题目】如图是元素周期表的一部分:

(1)元素⑩原子结构示意图为__________.
(2)元素③④的第一电离能大小关系为_______(填化学用语,下同),原因是__________________。④-⑧中最高价氧化物对应水化物酸性最强的是_______.
(3)写出元素⑦的最高价氧化物与NaOH溶液反应的离子方程式_________。
(4)元素⑤ 与⑧ 元素相比,非金属性较强的是__________(用元素符号表示),下列表述中能证明这一事实的是__________。
A.气态氢化物的挥发性和稳定性
B.两元素的电负性
C.单质分子中的键能
D.含氧酸的酸性
E.氢化物中X—H键的键长
F.两单质在自然界中的存在形式
(5)根据下列五种元素的第一至第四电离能数据(单位:KJ·mol﹣1),回答下面各题:
元素代号 | I1 | I2 | I3 | I4 |
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
①T元素最可能是________(填“s”、“p”、“d”、“ds”等)区元素;
在周期表中,最可能处于同一主族的是_________.(填元素代号),
②下列离子的氧化性最弱的是______________。
A.S2+ B.R2+ C.U+ D.T3+

