题目内容
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 标准状况下,22.4 L H2O 的分子数为 NA
B. 1 mol NH4+ 所含质子数为10NA
C. 物质的量浓度为0.5mol·L-1 的 MgCl2 溶液,含有的 Cl-数为 NA
D. 常温常压下,32g O2和O3的混合气体所含原子数为2NA
【答案】D
【解析】
A.标况下,水不是气体,不能使用气体摩尔体积,选项A错误;B、1molNH4+所含质子数为11NA,选项B错误;C.溶液体积未知,无法计算Cl-个数,选项C错误;D.O2和O3都是由氧原子构成,n(O)=![]() =
=![]() =2mol,2mol×NA/mol=2NA,所以所含氧原子数为2NA,选项D正确;答案选D。
=2mol,2mol×NA/mol=2NA,所以所含氧原子数为2NA,选项D正确;答案选D。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】三氯化六氨合钴(Ⅲ)是一种重要的配合物原料,实验室制备实验流程如下:
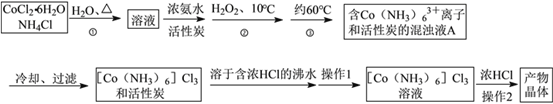
已知:[Co(NH3)6]Cl3在水中电离为[Co(NH3)6]3+和Cl-,[Co(NH3)6]Cl3的溶解度如下表:
温度(℃) | 0 | 20 | 47 |
溶解度(g) | 4.26 | 6.96 | 12.74 |
(1)第①步需在煮沸NH4Cl溶液中加入研细的CoCl2·6H2O晶体,加热煮沸与研细的目的是__
(2)实验室制备三氯化六氨合钴(III)的化学方程式为:____________
(3)实验操作1为 _________[Co(NH3)6]Cl3溶液中加入浓盐酸的目的是_____
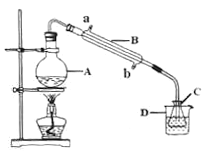
(4)现称取0.2675g[Co(NH3)6]Cl3(相对分子质量为267.5),在A中发生如下反应:[Co(NH3)6]Cl3+3NaOH![]() Co(OH)3↓+6NH3↑+3NaCl(装置见右下图),C中装0.5000mol·L-1的盐酸25.00mL,D中装有冰水。加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端外壁上粘附的酸液于C中,加入2-3滴甲基红指示剂,用0.5000mol·L-1的NaOH滴定。
Co(OH)3↓+6NH3↑+3NaCl(装置见右下图),C中装0.5000mol·L-1的盐酸25.00mL,D中装有冰水。加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端外壁上粘附的酸液于C中,加入2-3滴甲基红指示剂,用0.5000mol·L-1的NaOH滴定。
已知: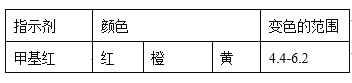
①当滴定到终点时,共需消耗NaOH溶液___mL(准确到0.01mL)。
②当用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,则x值将______(填“偏大”、“偏小”或“不变”)
