题目内容
11.A、X、Y、Z和W是原子序数依次增大的五种短周期元素.A和X可组成两种常温下为液态的化合物A2X、A2X2,X和Y也可组成两种常温下为固态的化合物Y2X、Y2X2,且Y2X、Y2X2的焰色反应均为黄色,在元素周期表中,A与Y同主族,X与Z相邻,Z与W相邻.请回答:(1)A2X2的结构式H-O-O-H,Y2X2的电子式
 ;
;(2)X、Z两种元素的氢化物中稳定性较高的是H2O(填化学式,下同);Z、W两种元素的最高价氧化物对应的水化物中酸性较强的是HClO4;
(3)W元素在周期表中的位置为第三周期ⅦA族;
(4)将W的单质与ZX2同时通入水中,生成两种强酸,请写出其反应的化学方程式:Cl2+SO2+2H2O=2HCl+H2SO4.
分析 A、X、Y、Z和W是原子序数依次增大的五种短周期元素.A和X可组成两种常温下为液态的化合物A2X、A2X2,应是H2O、H2O2,则A为H、X为O;X和Y也可组成两种常温下为固体的化合物Y2X、Y2X2,且Y2X、Y2X2的焰色反应均为黄色,含有Na元素,则Y为Aa;在元素周期表中,X与Z相邻,Z与W相邻,结合原子序数可知,Z、W处于第三周期,由位置关系可推知X、Z应同主族,故Z为S、W为Cl,据此解答.
解答 解:A、X、Y、Z和W是原子序数依次增大的五种短周期元素.A和X可组成两种常温下为液态的化合物A2X、A2X2,应是H2O、H2O2,则A为H、X为O;X和Y也可组成两种常温下为固体的化合物Y2X、Y2X2,且Y2X、Y2X2的焰色反应均为黄色,含有Na元素,则Y为Aa;在元素周期表中,X与Z相邻,Z与W相邻,结合原子序数可知,Z、W处于第三周期,由位置关系可推知X、Z应同主族,故Z为S、W为Cl,
(1)A2X2为H2O2,分子中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对,故其结构式为H-O-O-H,Y2X2为Na2O2,由钠离子与过氧根离子构成,过氧根离子中氧原子之间形成1对共用电子对,且氧原子满足8电子结构,其电子式为: ,
,
故答案为:H-O-O-H; ;
;
(2)X、Z两种元素的氢化物分别为H2O、H2S,由于非金属性O>S,故稳定性H2O>H2S;
Z、W两种元素的最高价氧化物对应的水化物分别为:H2SO4,HClO4,非金属性Cl>S,故HClO4酸性较强,
故答案为:H2O;HClO4;
(3)W为Cl元素,在周期表中的位置为:第三周期ⅦA族,
故答案为:第三周期ⅦA族;
(4)将氯气与SO2同时通入水中,生成两种强酸,反应的化学方程式:Cl2+SO2+2H2O=2HCl+H2SO4,
故答案为:Cl2+SO2+2H2O=2HCl+H2SO4.
点评 本题考查结构性质位置关系应用,难度不大,根据物质的状态及焰色反应进行推断,注意对元素周期律的理解掌握.

| A. | H2O和H2O2 | B. | 12C和14C | C. | O2和O3 | D. | SO2和SO3 |
| A. | 常温常压下,18g(H218O)含有的原子总数为3NA | |
| B. | 标准状况下,4.2g CH2=CH2气体中所含有的碳原子总数为0.3NA | |
| C. | 将0.1mol的Cl2通入1L水中转移的电子数目为0.1NA | |
| D. | 0.1mol/LAl2(SO4)3溶液中含有的Al3+总数为0.2NA |
| A. | C3H6 | B. | CH2O2 | C. | C2H6O | D. | C3H6O2 |
| A. | 晶格能大小:NaI>NaBr>NaCl>NaF | B. | 单质的熔点:Li<Na<K<Rb | ||
| C. | 共价键的键能:C-C>C-Si>Si-Si | D. | 沸点高低:HF<HCl<HBr<HI |
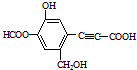
| A. | 该有机物分子式为:C11H10O6 | |
| B. | 分子中最多有9个碳原子共平面 | |
| C. | 该有机物可发生取代反应、还原反应,不能发生银镜反应 | |
| D. | 1 mol该有机物分别与足量Na、NaOH溶液、NaHCO3溶液完全反应,消耗Na、NaOH、NaHCO3的物质的量分别为3mol、4mol、1 mol |
 有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1.请回答下列问题:
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1.请回答下列问题: