题目内容
13.三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,在110℃可完全失去结晶水.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:(1)铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250ml溶液.
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+.向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,
溶液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02ml,滴定中MnO4-,被还原成Mn2+.
重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98ml
请回答下列问题:
①配制三草酸合铁酸钾溶液的操作步骤依次是:称量、溶解、转移、洗涤并转移、定容摇匀.下列操作会使配制的三草酸合铁酸钾溶液浓度偏低的是AC
A.没有洗涤烧杯和玻璃棒
B.选用的容量瓶内有少量蒸馏水
C.如果加水超过了刻度线,吸出水使液面恰好到刻度线
D.整个配制过程中,容量瓶不振荡
②加入锌粉的目的是将Fe3+恰好还原成Fe2+.
③写出步骤三中发生反应的离子方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
④实验测得该晶体中铁的质量分数为11.20%或0.112.在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量偏高.(选填“偏低”“偏高”“不变”)
(2)结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量.请纠正实验过程中的两处错误;加热后的晶体要在干燥器中冷却;;两次称量质量差不超过0.1g.
分析 (1)①根据配制一定物质的量浓度的溶液的操作步骤判断:在配制物质的量浓度的溶液时,要经过:计算→称量→溶解→移液、洗涤→振荡→定容→摇匀等步骤;
A.没有洗涤烧杯和玻璃棒,导致配制的溶液中溶质的物质的量偏小;
B.选用的容量瓶内有少量蒸馏水,不影响沉淀结果;
C.如果加水超过了刻度线,吸出水使液面恰好到刻度线,导致容量瓶中溶质的物质的量偏小,浓度偏低;
D.整个配制过程中,容量瓶不振荡,会导致配制的溶液体积偏小,溶液浓度偏高;
②锌粉能与Fe3+反应,加入锌粉的目的是将Fe3+恰好还原成Fe2+;
③根据物质的性质和书写离子方程式的有关要求书写离子方程式;
④根据离子方程式计算,n(Fe)=5n(MnO4-)=5×$\frac{20.02mL+19.98mL}{2}$×0.01mol•L-1×10-3×10=1.0×10-2mol,m(Fe)=56 g•mol-1×1.0×10-2mol=0.56g.晶体中铁的质量分数=$\frac{0.56g}{5g}$×100%=11.2%,若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高;
(2)加热后的晶体要在干燥器中冷却,防止重新吸收空气中的水分.另外在加热时至少要称量两次质量差,到两次称量质量差不超过0.1 g.
解答 解:(1)①在配制物质的量浓度的溶液时,要经过:计算→称量→溶解→移液、洗涤→振荡→定容→摇匀等步骤;
A.没有洗涤烧杯和玻璃棒,则配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故A正确;
B.选用的容量瓶内有少量蒸馏水,对溶质和最终配制溶液体积不影响,则不影响沉淀结果,故B错误;
C.如果加水超过了刻度线,吸出水使液面恰好到刻度线,导致容量瓶中溶质的物质的量偏小,配制的浓度偏低,故C正确;
D.整个配制过程中,容量瓶不振荡,先加入的是密度较大的溶液,后加入的洗涤烧杯和玻璃棒的溶液密度较小,造成溶液密度不均匀,如果摇均匀密度大的和密度小的相溶体积会比二者原体积之和小,配制的溶液浓度偏高,故D错误;
故答案为:溶解;定容;AC;
②加入锌粉的目的是将Fe3+恰好还原成Fe2+,
故答案为:将Fe3+恰好还原成Fe2+;
③在步骤三中发生的离子反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
④根据步骤三中的离子反应可知:n(Fe)=5n(MnO4-)=5×$\frac{20.02mL+19.98mL}{2}$×0.01 mol•L-1×10-3×10=1.0×10-2mol,m(Fe)=56 g•mol-1×1.0×10-2mol=0.56g.晶体中铁的质量分数为:$\frac{0.56g}{5g}$×100%=11.20%,
若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高,
故答案为:11.20%或0.112;偏高;
(2)加热后的晶体要在干燥器中冷却,防止重新吸收空气中的水分.另外在加热时至少要称量两次质量差,到两次称量质量差不超过0.1 g,故答案为:加热后的晶体要在干燥器中冷却; 两次称量质量差不超过0.1 g.
点评 本题考查探究物质组成、测量物质含量的方法,题目难度中等,涉及到溶液的配制、滴定和结晶等操作、质量分数的计算等知识,注意基础实验知识的积累,把握实验步骤、原理和注意事项等问题.

| A. | 晶格能大小:NaI>NaBr>NaCl>NaF | B. | 单质的熔点:Li<Na<K<Rb | ||
| C. | 共价键的键能:C-C>C-Si>Si-Si | D. | 沸点高低:HF<HCl<HBr<HI |
| A. | C的燃烧热为Q1 kJ/mol | |
| B. | 2 mol CO(g)所具有的能量一定高于2 mol CO2(g)所具有的能量 | |
| C. | 一定质量的C燃烧,生成CO2(g)比生成CO(g)时放出的热量多 | |
| D. | C燃烧生成CO2气体的热化学方程式为:C(s)+O2(g)═CO2(g)△H=-(Q1+Q2) kJ/mol |
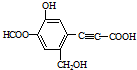
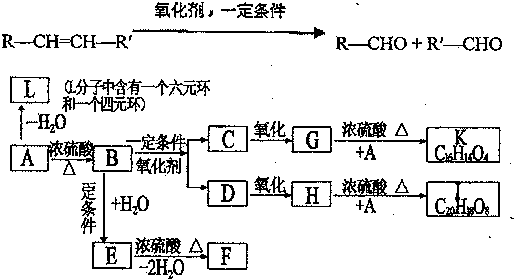
| A. | 该有机物分子式为:C11H10O6 | |
| B. | 分子中最多有9个碳原子共平面 | |
| C. | 该有机物可发生取代反应、还原反应,不能发生银镜反应 | |
| D. | 1 mol该有机物分别与足量Na、NaOH溶液、NaHCO3溶液完全反应,消耗Na、NaOH、NaHCO3的物质的量分别为3mol、4mol、1 mol |
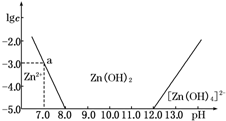 如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.回答下列问题:
如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.回答下列问题:(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为Zn2++4OH-═[Zn(OH)4]2-.
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17.
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是8.0<pH<12.0.
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表:
| c(HCl) | |||||||
| (mol/L) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| 103 c(PbCl2) | |||||||
| (mol/L) | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50mol/L盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水.
| A. | 氯化钙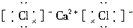 | B. | 硫化钠 | C. | 氮气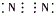 | D. | 二氧化碳 |
 、K
、K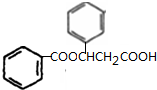 ;
; $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$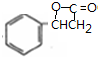 +H2O,反应类型取代反应或酯化反应;
+H2O,反应类型取代反应或酯化反应; .
.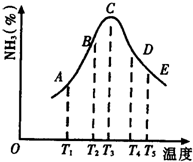 (1)在容积不同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2+3H2?2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如图:
(1)在容积不同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2+3H2?2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如图: $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$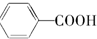
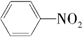 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$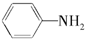 (苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示:
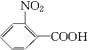
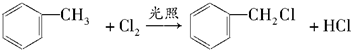
(苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示: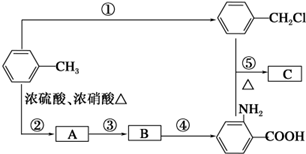
 .
. ;
; .
.