题目内容
9.下列说法中正确的是( )| A. | 丙烯分子中有8个 σ 键,1个 π 键 | |
| B. | 在晶体中,1个Si原子和2个O原子形成2个共价键? | |
| C. | NCl3和 BCl3分子中,中心原子都采用sp3 杂化 | |
| D. | 在“冰→水→水蒸气→氧气和氢气”的变化过程中,各阶段被破坏的粒子间主要的相互作用依次是氢键、分子间作用力、极性键 |
分析 A.根据丙烯的结构简式CH3-CH=CH2判断;
B.硅形成四个Si-O键;
C.根据价层电子对判断;
D.冰→水→水蒸气的过程为物理变化,破坏的是分子间作用力,主要是氢键,水蒸气→氧气和氢气是化学变化,破坏的是化学键,为极性键.
解答 解:A.C-C、C-H键均为σ键,C=C中一个σ键,一个π键,则丙烯分子有8个σ键,1个π键,故A正确;
B.在晶体中,1个Si原子和2个O原子形成4个共价键,故B错误;
C.NCl3中N原子成3个N-Cl键,还有1对孤对电子,杂化轨道数是4,故N原子采取sp3杂化,BCl3分子中N原子成3个B-Cl键,没有孤对电子,杂化轨道数是3,故B原子采取sp2杂化,故C错误;
D.固态水中和液态水中含有氢键,当冰→水→水蒸气主要是氢键被破坏,但属于物理变化,共价键没有破坏,水蒸气→氧气和氢气,为化学变化,破坏的是极性共价键,另外氢键属于分子间作用力,故D错误.
故选A.
点评 本题考查化学键,为高频考点,把握化学键的形成、分类及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意结合实例分析,题目难度不大.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
4.已知化学反应①C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-Q1 kJ/mol②2CO(g)+O2(g)═2CO2(g)△H=-Q2 kJ/mol.据此判断,下列说法正确的是(Q1、Q2均为正数,且其他条件相同)( )
| A. | C的燃烧热为Q1 kJ/mol | |
| B. | 2 mol CO(g)所具有的能量一定高于2 mol CO2(g)所具有的能量 | |
| C. | 一定质量的C燃烧,生成CO2(g)比生成CO(g)时放出的热量多 | |
| D. | C燃烧生成CO2气体的热化学方程式为:C(s)+O2(g)═CO2(g)△H=-(Q1+Q2) kJ/mol |
1.某有机物结构简式如图所示,下列说法正确的是( )
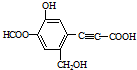

| A. | 该有机物分子式为:C11H10O6 | |
| B. | 分子中最多有9个碳原子共平面 | |
| C. | 该有机物可发生取代反应、还原反应,不能发生银镜反应 | |
| D. | 1 mol该有机物分别与足量Na、NaOH溶液、NaHCO3溶液完全反应,消耗Na、NaOH、NaHCO3的物质的量分别为3mol、4mol、1 mol |
18.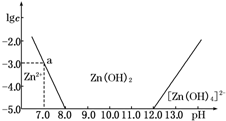 如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.回答下列问题:
如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为Zn2++4OH-═[Zn(OH)4]2-.
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17.
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是8.0<pH<12.0.
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表:
根据上表数据判断下列说法正确的是A、B、C、D.
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50mol/L盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水.
 如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.回答下列问题:
如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.回答下列问题:(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为Zn2++4OH-═[Zn(OH)4]2-.
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17.
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是8.0<pH<12.0.
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表:
| c(HCl) | |||||||
| (mol/L) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| 103 c(PbCl2) | |||||||
| (mol/L) | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50mol/L盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水.
7.有关物质的燃烧热数据如下表所示,
则1mol CH3OH(1)与CO(g)反应生成CH3COOH(1)的反应热为( )
| 物质 | CH3OH(l) | CO(g) | CH3COOH(l) |
| △H/kJ•mol-1 | -727 | -283 | -875 |
| A. | -135kJ/mol | B. | -331kJ/mol | C. | +135kJ/mol | D. | +148kJ/mol |