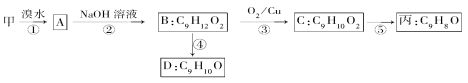
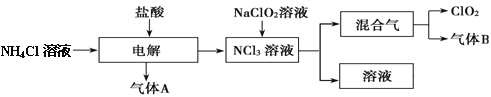
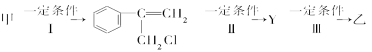题目内容
【题目】A、B、C、D为短周期内除稀有气体外的元素,它们的原子序数依次增大。四种元素中只有C为金属元素;A和C的最外层电子数相等;B、D属于同主族;C、D两元素原子的质子数之和为A、B两元素原子的质子数之和的3倍。请回答下列问题:
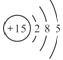
(1)A的元素符号为______,B的原子结构示意图为______。
(2)写出C2B2与A2B反应的离子方程式____ _。
(3)A、B、C、D离子半径由大到小的顺序为 。(用离子符号表示)
(4)用化学方程式证明元素原子的得电子能力B强于D__ ___。
【答案】(1)H;![]() ;
;
(2)2Na2O2+2H2O═4Na++4OH-+O2↑;
(3)S2->O2->Na+>H+;
(4)2H2S+O2═2H2O+S↓。
【解析】试题分析:A、B、C、D为短周期内除稀有气体外的元素,它们的原子序数依次增大,C为金属元素;A和C的最外层电子数相等,位于同主族,则C为Na,A为H;B、D属于同主族,设B的质子数为x,则D的质子数为x+8,C、D两元素原子的质子数之和为A、B两元素原子的质子数之和的3倍,所以11+x+8=(1+x)×3,解得x=8,即B为O,D为S。(1)A为H,B为O,其原子结构示意图为![]() ;(2)C2B2为Na2O2,钠离子与过氧根离子以离子键结合,O、O之间以共价键结合,与水反应的离子反应为2Na2O2+2H2O═ 4Na++ 4OH-+O2↑;;(3)离子核外电子层越多,离子半径越大,具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为S2->O2->Na+>H+;(4)利用元素单质的置换反应可说明得电子能力的强弱,如2H2S+O2═2H2O+S↓。
;(2)C2B2为Na2O2,钠离子与过氧根离子以离子键结合,O、O之间以共价键结合,与水反应的离子反应为2Na2O2+2H2O═ 4Na++ 4OH-+O2↑;;(3)离子核外电子层越多,离子半径越大,具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为S2->O2->Na+>H+;(4)利用元素单质的置换反应可说明得电子能力的强弱,如2H2S+O2═2H2O+S↓。

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目