��Ŀ����
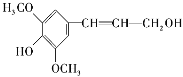
����Ŀ��̫���ܵ�ذ���ϳ��������⣬����ͭ�������ء����Ȼ�ѧ���ʡ�
��1����̬��ԭ�ӵĵ����Ų�ʽ��_______________��
��2����һ���������л��軯����й��顣�������ɡ��ṹ����Ӧ���������ơ������й��ȡ____�ӻ���ʽ������ķе�����Է��������Ĺ�ϵ��ͼ��ʾ���������ֱ仯��ԭ����_______________��
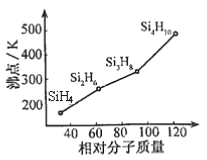
��3��������ͬΪVIA��Ԫ�أ��������ڵ�Ԫ��������壬������Ԫ�صĵ縺����С�����˳��Ϊ_______�� (��Ԫ�ط��ű�ʾ)
��4����̬SeO3���ӵ����幹��Ϊ_________����SeO3��Ϊ�ȵ������һ������Ϊ____________(�ѧʽ)��
��5��һ��ͭ��Ͻ�����������������ܶѻ��ṹ���ھ����н�ԭ��λ�ڶ��㣬ͭԭ��λ�����ģ���úϽ��н�ԭ��(Au)��ͭԭ��(Cu)������Ϊ_________�����þ���ľ����ⳤΪa pm����úϽ��ܶ�Ϊ______g/cm 3��(�г�����ʽ����Ҫ�������������٤��������ֵΪNA)
���𰸡�
��1�� 1s2 2s22p63s23p2
��2�� sp3(1 ��) �������Է�������Խ���Ӽ䷶�»���Խǿ
��3�� As��Se��Br
��4�� ƽ��������(1 ��) CO32�� �� NO3��
��5�� 1��3 ��
��������
�����������1������14��Ԫ�أ�����ԭ�Ӻ�������Ų����ɿ���д�������Ų�ʽΪ��1s22s22p63s23p2��
��2�����ݹ���ķ���ʽ�ó��������ͨʽΪ��SinH2n+2���ֹ������ɡ��ṹ����Ӧ���������ƣ����Թ����й��ȡsp3�ӻ���ʽ������(SinH2n+2)���Ƿ��Ӿ��壬���Ӿ���ķе�ߵ�ȡ���ڷ��Ӽ��������������Ӽ�����������Է��������Ĵ�С�йأ��������Է�������Խ���Ӽ䷶�»���Խǿ
��3���顢����������Ԫ�ض��ǵ�4���ڷǽ���Ԫ�أ�ͬһ����Ԫ��������ҵ縺�Գ��������ƣ��ʵ縺��As��Se��Br
��4����̬SeO3����������ԭ�ӵļ۲���Ӷ���Ϊ![]() =3���µ��Ӷԣ����Է��ӹ���Ϊƽ�������Σ��ֵȵ�����Ҫ��ԭ��������ͬ���۵�������ͬ��������SeO3��Ϊ�ȵ������һ������ΪCO32-��NO3-
=3���µ��Ӷԣ����Է��ӹ���Ϊƽ�������Σ��ֵȵ�����Ҫ��ԭ��������ͬ���۵�������ͬ��������SeO3��Ϊ�ȵ������һ������ΪCO32-��NO3-
��5���ھ����У�Auԭ��λ�ڶ��㣬Cuԭ��λ�����ģ��þ�����Auԭ�Ӹ���=8��![]() =1��Cuԭ�Ӹ���=6��
=1��Cuԭ�Ӹ���=6��![]() =3�����ԸúϽ���Auԭ����Cuԭ�Ӹ���֮��=1��3���������V=(a��10-10cm)3��ÿ��������ͭԭ�Ӹ�����3��Auԭ�Ӹ�����1�����=
=3�����ԸúϽ���Auԭ����Cuԭ�Ӹ���֮��=1��3���������V=(a��10-10cm)3��ÿ��������ͭԭ�Ӹ�����3��Auԭ�Ӹ�����1�����=![]() gcm-3��
gcm-3��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����п�����ᷴӦ��ʵ���У�ijͬѧ�õ��Ľ�����±���ʾ��
п������/g | п����״ | �¶�/�� | п��ȫ�ܽ��ʱ��/s | |
A | 2 | ��Ƭ | 5 | 400 |
B | 2 | ��Ƭ | 15 | 200 |
C | 2 | ��Ƭ | 25 | 100 |
D | 2 | ��Ƭ | 35 | t1 |
E | 2 | ���� | 15 | t2 |
F | 2 | ��ĩ | 15 | t3 |
G | 2 | ��Ƭ(����������Cu) | 35 | t4 |
��1����Ӧ�����ӷ���ʽ�� ���÷�ӦΪ ��Ӧ������ȡ������ȡ�����
��2��t1��________s, �������ʱ����¶ȵ�����ͼ(�����ʾʱ�䣬�����ʾ�¶�)��

��3����������������ͼ��������ݣ��ɵó��÷�Ӧ���¶�Ӱ�췴Ӧ���ʵĹ�����__________��
��4��t1______(���������)t4��ԭ����________________________________��
t2________t3(���������)��ԭ����_______________________________��