题目内容
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)海带中富含碘,请简述检验碘的实验方案_____________________;
(2)已知反应2HI(g)═H2(g)+I2(g)的△H=+11kJmol-1,1molH2(g)、1molHI(g)分子中化学键断裂时分别需要吸收436KJ、299KJ的能量,则1molI2(g)分子中化学键断裂时需吸收的能量为_________kJ;
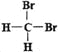
(3)Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
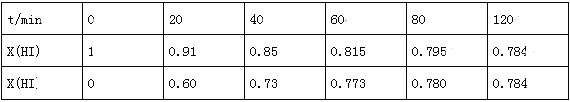
①根据上述实验结果,该反应的平衡常数K的计算式为:______________;(不用求出结果)
②其他条件不变,向平衡后体系中再加入少量HI,则平衡向_______(填“正”或“逆”)反应方向移动,达到平衡后x(HI)_______(填“增大”、“减小”或“不变”)。
③上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为_______(以K和K正表示);若k正=0.0027min-1,在t=40min时,v正=________min-1.
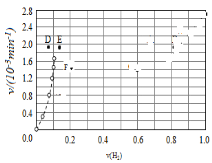
④由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为__________(填字母)。

【答案】
(1)取海带灼烧成灰,加水浸取后过滤,向滤液中加入硫酸与双氧水,再加淀粉试液变蓝,说明含有碘。
(2)151kJ
(3)① ![]() ② 正 不变 ③
② 正 不变 ③ ![]() 1.95×10-3min-1 ④A 、E
1.95×10-3min-1 ④A 、E
【解析】
试题分析:(1)海带中的碘元素以I-形式存在,故需要将其氧化为I2,利用淀粉检验即可,具体实验方案是取海带灼烧成灰,加水浸取后过滤,向滤液中加入硫酸与双氧水,再加淀粉试液变蓝,说明含有碘。
(2)设1molI2(g)分子中化学键断裂时需吸收的能量为x kJ,则:2×299 kJ-436kJ-xkJ=11kJ,解得x=151;
(4)①表中第一列,由HI分解建立平衡,表中第二列向逆反应进行建立平衡,由第一列数据可知,平衡时HI物质的量分数为0.784,则氢气、碘蒸汽总物质的量分数为1-0.784=0.216,而氢气、与碘蒸汽物质的量分数相等均为0.108,反应前后气体体积不变,用物质的量分数代替浓度计算平衡常数,则平衡常数K=![]() =
=![]() ;
;
②增大反应物的量,平衡向正方向移动,但反应体系体积变化为0,最终平衡状态不变,故达到平衡后x(HI)不变;
③到达平衡时,正、逆反应速率相等,则k正x2(HI)=k逆x(H2)x(I2),则k逆=k正×![]() =
=![]() ,在t=40min时,正反应建立平衡的x(HI)=0.85,则v正=k正x2(HI)=0.0027min-1×0.852=1.95×10-3min-1;
,在t=40min时,正反应建立平衡的x(HI)=0.85,则v正=k正x2(HI)=0.0027min-1×0.852=1.95×10-3min-1;
④对于2HI(g)![]() H2(g)+I2(g)反应建立平衡时:升高温度,正、逆反应速率均加快,因此排除C点,正反应为吸热反应,升高温度,平衡向吸热反应方向移动,因此平衡正向移动,再次平衡时HI的物质的量分数减小,因此排除B点,故选A点;对于H2(g)+I2(g)2HI(g)反应建立平衡时:升高温度,正、逆反应速率均加快,升高温度,平衡向吸热反应方向移动,因此平衡逆向移动,再次平衡时H2的物质的量分数增大,故选E点;因此反应重新达到平衡,v正~x(HI)对应的点为A,v逆~x(H2)对应的点为E,故答案为A、E。
H2(g)+I2(g)反应建立平衡时:升高温度,正、逆反应速率均加快,因此排除C点,正反应为吸热反应,升高温度,平衡向吸热反应方向移动,因此平衡正向移动,再次平衡时HI的物质的量分数减小,因此排除B点,故选A点;对于H2(g)+I2(g)2HI(g)反应建立平衡时:升高温度,正、逆反应速率均加快,升高温度,平衡向吸热反应方向移动,因此平衡逆向移动,再次平衡时H2的物质的量分数增大,故选E点;因此反应重新达到平衡,v正~x(HI)对应的点为A,v逆~x(H2)对应的点为E,故答案为A、E。

 口算题天天练系列答案
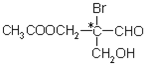
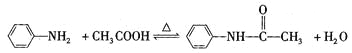
口算题天天练系列答案【题目】乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂和防腐剂、乙酰苯胺的制备原理为
实验参数
名称 | 相对分 | 性状 | 密度(g/mL) | 沸点( | 溶解性 | |
苯胺 | 93 | 无色油状液体 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚 |
乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
乙酰 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,可溶于热水 | 易溶于乙醇、乙醚 |
实验装置如图所示(部分仪器及夹持装置已略去)。
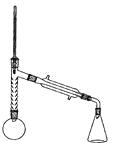
注:①刺型分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。②苯胺易被氧化。
实验步骤:
步骤1:在100mL圆底烧瓶中加入无水苯胺9.3mL、冰醋酸18.4mL、锌粉0.1g和少量沸石,安装好仪器后,对圆底烧瓶均匀加热,使反应液在微沸状态下回流,调节加热温度,使温度计温度控制在105![]() 左右;反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热。
左右;反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热。
步骤2:在搅拌下,趁热将蒸馏烧瓶中的液体以细流状倒入盛有冰水的100mL烧杯中,快速搅拌,乙酰苯胺结晶析出,烧杯内试剂冷却至室温后,进行抽滤、洗涤、干燥,可得到乙酰苯胺粗品。
步骤3:将乙酰苯胺粗品进行重结晶,待结晶完全后抽滤,尽量压甘干滤饼。将产品置于干净的表面皿中晾干,称重,计算产率、
请回答下列问题:
(1)实验中加入锌粉的目的是_____________________。
(2)从化学平衡的角度分析,控制温度计的温度在105![]() 左右的原因是______________。
左右的原因是______________。
(3)通过_____________可判断反应基本完成、
(4)步骤1加热可用_____________(填“水浴”或“油浴”)。
(5)洗涤乙酰苯胺粗品最合适的方法是__________________(填字母)。
A.用少量冷水洗
B.用少量热水洗
C.先用冷水洗,再用热水洗
D.用酒精洗
(6)步骤2得到的粗品中因含有某些杂质而颜色较深,步骤3重结晶的操作是:将粗品用热水溶解,加入活性炭0.1g,煮沸进行脱色,______________,再将滤液冷却结晶。
(7)该实验最终得到产品9.1g,则乙酰苯胺的产率是____________(小数点后保留两位数字。)