题目内容
【题目】材料是人类文明进步的阶梯,第ⅢA、ⅣA、VA及Ⅷ族元素是组成特殊材料的重要元素。
回答下列问题:
(1)基态硼核外电子占据的最高能级的电子云轮廓图形状为____。与硼处于同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为___。
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态氮原子的未成对电子数相同,则其基态原子的价层电子排布式为____。
(3)NH3能与众多过渡元素离子形成配合物,向CuSO4溶液中加入过量氨水,得到深蓝色溶液,向其中加人乙醇析出深蓝色晶体,加入乙醇的作用____,该晶体的化学式为_____。
(4)铜与(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2中含有π键的数目为_____,HSCN结构有两种,硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的原因是_______。
(5)MgCO3的热分解温度_____(填“高于”或“低于”)CaCO3的原因是________。
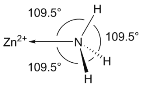
(6)NH3分子在独立存在时H-N-H键角为107°。如图是[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释NH3形成如图配合物后H-N-H键角变大的原因:_________。
(7)某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中位置如图所示,其堆积方式为_____,Li+占据阴离子组成的所有正四面体中心,该化合物的化学式为_____(用最简整数比表示)。假设晶胞边长为anm,NA代表阿伏伽德罗常数的值,则该晶胞的密度为________g/cm3。(用含a,NA的代数式表示)

【答案】哑铃形 C>Be>B 3d74s2 减小溶剂极性,降低晶体溶解度 [Cu(NH3)4SO4]H2O 4NA 异硫氰酸分子间可形成氢键,所以熔沸点较高 低于 r(Mg2+) < r(Ca2+),晶格能:MgO大于CaO,故MgCO3更易分解为MgO NH3分子中N原子的孤电子对进入Zn2+的空轨道形成配位键后,原孤电子对与成键电子对间的排斥作用变为成键电子对间的排斥,排斥作用减弱 面心立方最密堆积 LiB6H6 ![]()
【解析】
(1)基态B核外电子占据的最高能级为2p能级;同周期随原子序数的增大第一电离能呈增大趋势,但具有全充满、半充满、全空的电子层构型的原子稳定性高,其电离能较大;
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态氮原子的未成对电子数相同,则该元素原子3d能级容纳7个电子,原子先填充4s能级,再填充3d能级;
(3)加入乙醇能减小溶剂极性,降低[Cu(NH3)4]SO4晶体的溶解度,深蓝色的晶体:Cu(NH3)4SO4H2O;
(4)铜与类卤素(SCN)2反应生成Cu(SCN)2,SCN分子中硫原子形成两个共用电子对、C原子形成四个共用电子对、N原子形成三个共用电子对,(SCN)2结构式为N≡C-S-S-C≡N,每个分子中含有4个π键;能形成分子间氢键的物质熔沸点较高;
(5)碳酸盐的热分解本质是金属阳离子结合酸根离子中的氧离子,金属阳离子结合酸根离子中的氧离子能力越强,需要的更少外界能量来分解;
(6)孤电子对与成键电子对之间排斥力大于成键电子对之间的排斥力,NH3分子中N原子的孤电子对进入Zn2+的空轨道形成配位键后,原孤电子对与成键电子对间的排斥作用变为成键电子对间的排斥;
(7)由图可知,阴离子处于晶胞的顶点与面心,属于面心立方最密堆积;顶点阴离子与面心阴离子形成正四面体结构,晶胞中有8个正四面体,故晶胞中有8个Li+,均摊法计算晶胞中B12H12n-离子团数目,确定化学式;结合晶胞中各原子数目计算晶胞的质量,晶体密度=晶胞质量÷晶胞体积。
(1)基态B核外电子占据的最高能级为2p能级,电子云轮廓图形状为哑铃形;与硼处于同周期且相邻的两种元素为Be、C,同周期随原子序数的增大第一电离能呈增大趋势,Be原子的2s轨道为全充满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能:C>Be>B;
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态氮原子的未成对电子数相同,则该元素原子3d能级容纳7个电子,原子先填充4s能级,再填充3d能级,故该元素原子价电子排布式为:3d74s2;
(3)加入乙醇能减小溶剂极性,降低[Cu(NH3)4]SO4晶体的溶解度,深蓝色的晶体:Cu(NH3)4SO4H2O,所以乙醇的作用是减小溶剂极性,降低晶体溶解度;
(4)铜与类卤素(SCN)2反应生成Cu(SCN)2,SCN分子中硫原子形成两个共用电子对、C原子形成四个共用电子对、N原子形成三个共用电子对,(SCN)2结构式为N≡C-S-S-C≡N,每个分子中含有4个π键,则1mol(SCN)2中含有π键的数目为4NA或2.408×1024;能形成分子间氢键的物质熔沸点较高,异硫氰酸分子间可形成氢键,而硫氰酸不能形成分子间氢键,所以异硫氰酸熔沸点高于硫氰酸;
(5)碳酸盐的热分解本质是金属阳离子结合酸根离子中的氧离子,Mg2+的离子半径小于Ca2+的,Mg2+对氧离子的吸引作用比Ca2+的强,故MgCO3需要较少的外界能量来分解,故热分解温度:MgCO3低于CaCO3;
(6)NH3分子中N原子的孤电子对进入Zn2+的空轨道形成配位键后,原孤电子对与成键电子对间的排斥作用变为成键电子对间的排斥,排斥作用减弱,故NH3形成如图1配合物后H-N-H键角变大;
(7)由图可知,阴离子处于晶胞的顶点与面心,属于面心立方最密堆积;顶点阴离子与面心阴离子形成正四面体结构,晶胞中有8个正四面体,故晶胞中有8个Li+,晶胞中B12H12n-离子团数目=8×![]() +6×
+6×![]() =4,故Li、B、H原子数目之比为8:12×4:12×4=1:6:6,故化学式为LiB6H6.晶胞相当于含有8个“LiB6H6“,晶胞质量=8×
=4,故Li、B、H原子数目之比为8:12×4:12×4=1:6:6,故化学式为LiB6H6.晶胞相当于含有8个“LiB6H6“,晶胞质量=8×![]() g,故晶体密度=8×
g,故晶体密度=8×![]() g÷(a×10-7cm)3=
g÷(a×10-7cm)3=![]() g/cm3。
g/cm3。

 阅读快车系列答案
阅读快车系列答案【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示。

序号 | 条件 | 现象 | 结论 | |
温度/℃ | 催化剂 | |||
1 | 40 | FeCl3溶液 | ||
2 | 20 | FeCl3溶液 | ||
3 | 20 | MnO2 | ||
4 | 20 | 无 | ||
(1)实验1、2的目的是研究__________因素对H2O2分解速率的影响。
(2)实验1对应的化学方程式为___________________________。
实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图所示的实验。可通过观察_________得出结论。 有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____________________。
实验三:已知在高锰酸钾(KMnO4)酸性溶液和草酸(H2C2O4)溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显,但不久突然褪色,反应速率明显加快。
(1)写出硫酸酸化的高锰酸钾溶液和草酸溶液反应的化学方程式____________
(2)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是______。
(3)若用实验证明你的猜想/span>,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是__________。
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
(4)若实验过程中将2.0mL0.10mol/LH2C2O4溶液与4.0mL0.010mol/L酸性KMnO4溶液混合(忽略溶液混合后体积的变化),测得溶液的褪色时间为40s,这段时间内平均反应速率v(KMnO4)=__________mol·L-1·min-1。
【题目】下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
(1)⑤和⑧的元素符号是_______和_______。
(2)元素①的最高价氧化物的电子式是_________________,元素①的某种烃A分子的球棍模型为 ,则A分子中最多有______个原子共平面。
,则A分子中最多有______个原子共平面。
(3)元素⑦和⑨的最高价氧化物的水化物反应的离子方程式为:____________________。
(4)请用化学方程式表示比较⑦、⑩单质氧化性的强弱:_________________。