题目内容
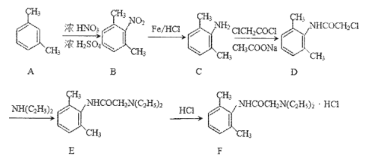
【题目】下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
(1)⑤和⑧的元素符号是_______和_______。
(2)元素①的最高价氧化物的电子式是_________________,元素①的某种烃A分子的球棍模型为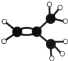 ,则A分子中最多有______个原子共平面。
,则A分子中最多有______个原子共平面。
(3)元素⑦和⑨的最高价氧化物的水化物反应的离子方程式为:____________________。
(4)请用化学方程式表示比较⑦、⑩单质氧化性的强弱:_________________。
【答案】P Ar ![]() 8 H++OH-=H2O 2KBr+Cl2=2KCl+Br2
8 H++OH-=H2O 2KBr+Cl2=2KCl+Br2
【解析】
根据元素周期表,可确定①为C元素、②为F元素、③为Mg元素、④为Al、⑤为P元素、⑥为S元素、⑦为Cl元素、⑧为Ar元素、⑨为K元素、⑩为Br元素,据此分析解答。
(1)根据分析,⑤为P元素,⑧为Ar元素;
(2) ①为C元素,最高价氧化物为CO2,其电子式是![]() ,烃A分子的球棍模型为
,烃A分子的球棍模型为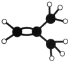 ,分子中含有碳碳双键,与碳碳双键直接相连的所有原子在同一平面,甲基上的氢原子最多只有一个与碳原子共面,则A分子中最多有8个原子共平面;
,分子中含有碳碳双键,与碳碳双键直接相连的所有原子在同一平面,甲基上的氢原子最多只有一个与碳原子共面,则A分子中最多有8个原子共平面;
(3)⑦为Cl元素,⑨为K元素,Cl元素最高价氧化物的水化物为HClO4,K元素最高价氧化物对应水化物为KOH,反应的离子方程式为:H++OH-=H2O;
(4)⑦为Cl元素,⑩为Br元素,氧化性强的可将氧化性弱的从其盐溶液中置换出单质,方程式为:2KBr+Cl2=2KCl+Br2。

 阅读快车系列答案
阅读快车系列答案【题目】水体砷污染已成为一个亟待解决的全球性环境问题,我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的正五价砷[As(Ⅴ)],其机制模型如下。
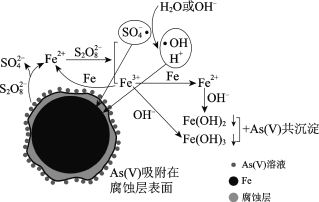
零价铁活化过硫酸钠去除废水中As(Ⅴ)的机制模型
资料:
Ⅰ.酸性条件下SO4·为主要的自由基,中性及弱碱性条件下SO4·和·OH同时存在,强碱性条件下·OH为主要的自由基。
Ⅱ.Fe2+、Fe3+形成氢氧化物沉淀的pH
离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe2+ | 7.04 | 9.08 |
Fe3+ | 1.87 | 3.27 |
(1)砷与磷在元素周期表中位于同一主族,其原子比磷多一个电子层。
① 砷在元素周期表中的位置是______。
② 砷酸的化学式是______,其酸性比H3PO4______(填“强”或“弱”)。
(2)零价铁与过硫酸钠反应,可持续释放Fe2+,Fe2+与S2O82反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As(Ⅴ)去除完全。
①S2O82中S的化合价是______。
②零价铁与过硫酸钠反应的离子方程式是______。
③Fe3+转化为Fe2+的离子方程式是______。
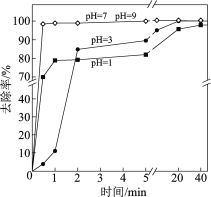
(3)不同pH对As(Ⅴ)去除率的影响如图。5 min内pH = 7和pH = 9时去除率高的原因是______。