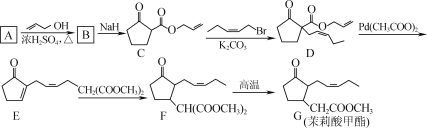
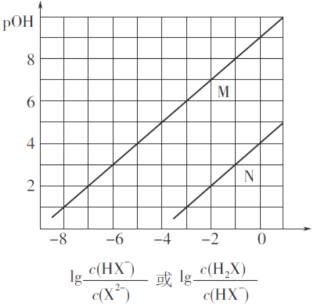
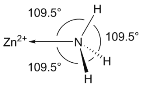
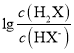题目内容
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示。

序号 | 条件 | 现象 | 结论 | |
温度/℃ | 催化剂 | |||
1 | 40 | FeCl3溶液 | ||
2 | 20 | FeCl3溶液 | ||
3 | 20 | MnO2 | ||
4 | 20 | 无 | ||
(1)实验1、2的目的是研究__________因素对H2O2分解速率的影响。
(2)实验1对应的化学方程式为___________________________。
实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图所示的实验。可通过观察_________得出结论。 有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____________________。
实验三:已知在高锰酸钾(KMnO4)酸性溶液和草酸(H2C2O4)溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显,但不久突然褪色,反应速率明显加快。
(1)写出硫酸酸化的高锰酸钾溶液和草酸溶液反应的化学方程式____________
(2)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是______。
(3)若用实验证明你的猜想/span>,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是__________。
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
(4)若实验过程中将2.0mL0.10mol/LH2C2O4溶液与4.0mL0.010mol/L酸性KMnO4溶液混合(忽略溶液混合后体积的变化),测得溶液的褪色时间为40s,这段时间内平均反应速率v(KMnO4)=__________mol·L-1·min-1。
【答案】温度 2H2O2 ![]() 2H2O+O2↑ 反应产生气泡的快慢 控制阴离子相同,排除阴离子的干扰
2H2O+O2↑ 反应产生气泡的快慢 控制阴离子相同,排除阴离子的干扰 ![]()
![]()
![]() 催化剂使反应速率加快(或生成的硫酸锰对反应具有催化作用,使反应速率加快) B 0.010
催化剂使反应速率加快(或生成的硫酸锰对反应具有催化作用,使反应速率加快) B 0.010
【解析】
根据外界条件对化学反应速率的影响分析解答;根据氧化还原反应中,利用化合价的升降配平,而后再进行物质的量计算。
实验一.(1) 实验1、2使用相同的催化剂,但温度不同,所以反应速率不同是由温度不同导致的,所以可以探究温度对H2O2分解速率的影响;
故答案为:温度;
(2)双氧水在催化剂的条件下,分解生成水和氧气,方程式为:2H2O2 ![]() 2H2O+O2↑;
2H2O+O2↑;
故答案为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
实验二. (1)比较Fe3+和Cu2+对H2O2分解的催化效果,可以通过观察产生气泡的快慢来比较,产生气泡快的,催化效果好;在探究Fe3+和Cu2+对H2O2分解的催化效果时,必须保持其他的条件相同,所以将FeCl3改为Fe2(SO4)3更为合理,可以避免由于阴离子不同造成的干扰;
故答案为:反应产生气泡的快慢;排除阴离子的干扰;
实验三. (1)酸性条件下,高锰酸钾溶液和草酸发生氧化还原反应,生成硫酸锰和二氧化碳气体,方程式为:![]()
![]()
![]() ;
;
故答案为:![]()
![]()
![]() ;
;
(2) KMnO4与H2C2O4反应生成硫酸锰,锰离子有催化作用,所以猜想还可能是生成的硫酸锰对反应具有催化作用,使反应速率加快;
故答案为:生成的硫酸锰对反应具有催化作用,使反应速率加快;
(3) 要想验证锰离子的是否具有催化作用,可以在做对比实验时,同时加入硫酸锰观察反应速率是否变化即可;
故答案为:B;
(4)草酸的物质的量为: 0.10mol/L×2.0×10-3L=0.0002mol,
高锰酸钾的物质的量为:0.010mol/L×4×10-3L=4×10-5mol,草酸与高锰酸钾的物质的量之比为:5:1,显然是草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为:![]() ,40s内的平均速率为:v(KMnO4)=
,40s内的平均速率为:v(KMnO4)=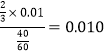 mol·L-1·min-1;故答案为: 0.010。
mol·L-1·min-1;故答案为: 0.010。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案【题目】根据下列实验操作和现象所得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向盛有少量苯酚稀溶液的试管中逐滴加入饱和溴水,产生白色沉淀 | 苯酚与Br2反应生成2,4,6三溴苯酚 |
B | 向H2O2溶液中滴入NaClO溶液,产生无色气体 | H2O2具有氧化性 |
C | 向FeCl3溶液中滴入少量KI溶液,再加入KSCN溶液,溶液变红 | Fe3+与I-的反应具有可逆性 |
D | 向蔗糖中滴加少量浓硫酸,搅拌,蔗糖变黑,体积膨松,变成疏松多孔的海绵状 | 浓硫酸具有脱水性和氧化性 |
A. AB. BC. CD. D