题目内容
12.用30g乙酸与46g乙醇反应,如果实际产率是理论产率的67%,则可得到的乙酸乙酯的质量是( )| A. | 29.5g | B. | 44g | C. | 59 g | D. | 88g |
分析 反应的方程式为:CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,根据乙酸和乙醇的质量关系判断反应的过量问题,根据不足量的物质计算乙酸乙酯的理论产量,再结合产率计算乙酸乙酯的实际产量.
解答 解:30g乙酸的物质的量为$\frac{30g}{60g/mol}$=0.5mol,46g乙醇的物质的量为$\frac{46g}{46g/mol}$=1mol,
发生反应:CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,由方程式可知乙醇过量,
CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O
1mol 1mol
0.5mol n
故n=0.5mol
故乙酸乙酯的理论产量为0.5mol×88g/mol,
则m实际=(CH3COOCH2CH3)=0.5mol×88g/mol×67%=29.5g,
故选A.
点评 本题考查化学方程式的计算,涉及过量计算与产率有关计算,侧重对基础知识的巩固.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19. (1)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧.这两个过程的热化学方程式为:
(1)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧.这两个过程的热化学方程式为:
a.C(s)+O2(g)═CO2(g)△H=E1①
b.C(s)+H2O(g)═CO(g)+H2(g)△H=E2②
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=E3③
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=E4④
请表达E1、E2、E3、E4之间的关系为E2=E1-E3-E4.
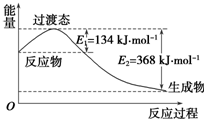
(2)如图所示是1摩尔NO2和1摩尔CO完全反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═NO(g)+CO2(g)△H=-234 kJ•mol-1.
(3)化学反应的焓变与反应物和生成物的键能有关.已知某些化学键的键能如下表所示:
则反应:H2(g)+Cl2(g)═2HCl(g)的焓变△H=-185 kJ/mol.
 (1)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧.这两个过程的热化学方程式为:
(1)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧.这两个过程的热化学方程式为:a.C(s)+O2(g)═CO2(g)△H=E1①
b.C(s)+H2O(g)═CO(g)+H2(g)△H=E2②
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=E3③
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=E4④
请表达E1、E2、E3、E4之间的关系为E2=E1-E3-E4.
(2)如图所示是1摩尔NO2和1摩尔CO完全反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═NO(g)+CO2(g)△H=-234 kJ•mol-1.
(3)化学反应的焓变与反应物和生成物的键能有关.已知某些化学键的键能如下表所示:
| 共价键 | H-H | Cl-Cl | H-Cl |
| 键能/(kJ•mol-1) | 436 | 247 | 434 |
20.食品添加剂通常必须在一定范围内使用,否则会损害人体健康,滥用下列食品添加剂会导致癌症发生率增加的是( )
| A. | KIO3 | B. | 苯甲酸钠 | C. | 维生素E | D. | NaNO2 |
7.分子式为C8H10O的苯的衍生物,其分子中含有两个互为对位的取代基,则其中不与NaOH 溶液反应的物质的种数为( )
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
17.下列说法正确的是( )
| A. | NH4Cl固体为离子化合物 | |
| B. | CO2分子中含有离子健 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16个纵行 | |
| D. | X2+的核外有18个电子,则X在第四周期第ⅡA族 |
1.X、Y、Z是同周期的三种元素,已知其最高价氧化物对应的水化物的酸性由强到弱的顺序是HXO4>H2YO4>H3ZO4.则下列说法正确的是( )
| A. | 元素的非金属性:X>Y>Z | B. | 原子半径:X>Y>Z | ||
| C. | 气态氢化物稳定性:X<Y<Z | D. | 原子序数:Z>Y>X |
2.肼(N2H4)一空气燃料电池是一种环保碱性燃料电池,其电解质溶液是20%-30%的KOH溶液.电池总反应为:N2H4+O2═N2↑+2H2O.下列关于该燃料电池工作时的说法正确的是( )
| A. | 溶液中阴离子物质的量基本不变 | |
| B. | 正极的电极反应式是:O2+4H++4e-═2H2O | |
| C. | 正极的电极反应式是:N2H4+4OH--4e═4H2O+N2↑ | |
| D. | 溶液中阴离子向正极移动 |